셀트리온, 美 FDA에 ‘램시마SC’ 신약 허가 신청 완료
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
2건의 글로벌 3상서 유효성 및 안전성 확보
신약 지위 확보로 높은 판가 전망
신약 지위 확보로 높은 판가 전망
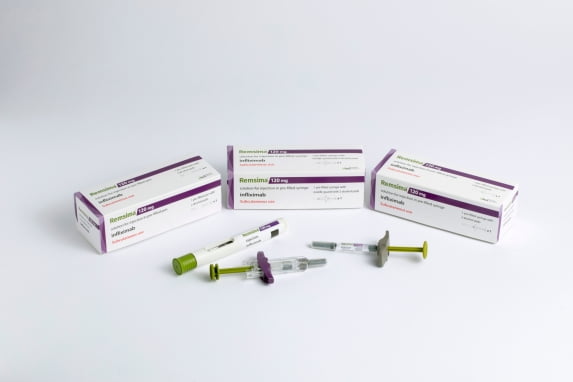
램시마SC는 기존 정맥주사(IV) 제형인 램시마(성분명 인플릭시맙)를 피하주사(SC)로 제형을 변경한 세계 최초의 제품이다. 현재 국내와 유럽 캐나다 등 40여개 국가에서 판매 허가를 획득했다. 미국에서는 허가 협의 단계에서 차별성을 인정받아 FDA로부터 신약 허가 과정 진행을 권고 받았다.
임상 결과 램시마SC는 2건의 임상 모두에서 위약 대조군 대비 통계적으로 유의하게 높은 유효성을 보여 우월성을 입증했다. 안전성에서도 위약 대조군과의 유의미한 차이를 보이지 않았다고 했다. 셀트리온은 이 결과를 바탕으로 FDA에 허가를 제출했다.
램시마SC가 미국에서 허가를 받으면 앞서 출시된 램시마IV 제형과의 상생(시너지)효과를 낼 것으로 기대된다.
회사는 램시마SC가 신약 지위를 기반으로 바이오시밀러(바이오의약품 복제약)보다 높은 판매가격을 받을 것으로 기대하고 있다. 또 판매권을 가진 셀트리온헬스케어가 미국에서 직접 판매 체계를 구축함으로써, 판매비 절감을 통해 수익성이 높은 제품으로 자리매김할 전망이라고 전했다.
셀트리온 관계자는 “램시마SC는 앞서 진출한 유럽에서 빠른 투약 효과와 제형의 편의성을 앞세워 이미 12%가 넘는 시장점유율을 보이며 빠르게 영향력을 확대하고 있다”며 “램시마SC가 세계 최대 인플릭시맙 시장인 미국에서 신약 지위를 확보하면 램시마 제품군의 입지를 한층 강화할 수 있을 것”이라고 말했다.
김예나 기자 yena@hankyung.com


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


