美제론, 첫 올리고핵산 항암제 3상 성공…에스티팜 기대감↑
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
에스티팜 원료 공급 추정
미국 제론코퍼레이션이 ‘이메텔스타트’의 골수이형성증후군(MDS) 임상 3상에 성공했다. 이 소식에 국내 에스티팜에 대한 기대감도 커지고 있다. 에스티팜이 이메텔스타트의 원료를 공급하고 있는 것으로 추정돼서다.
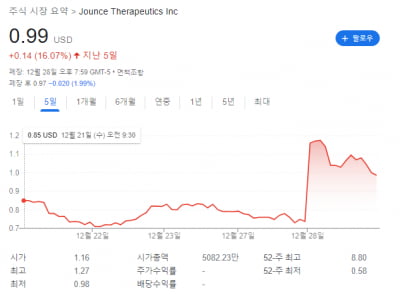
제론은 이메텔스타트의 골수이형성증후군 임상 3상 결과, 주요 유효성 평가지표를 충족했다고 4일(현지시간) 밝혔다. 올해 미국과 유럽에서 품목허가 신청을 예고했다. 승인받으면 첫 올리고핵산 항암제가 된다. 제론의 주가는 32.92% 급등했다.
제론은 재발성 및 불응성 또는 적혈구 생성자극제(ESA)에 부적격인 저위험 MDS 환자를 대상으로 임상 3상을 진행했다. 1차 유효성 평가지표는 8주 수혈 독립성(transfusion independence, TI)이다. 치료 기간 중 8주 연속으로 적혈구 수혈을 받지 않은 환자의 비율을 의미한다. 이메텔스타트 투여군 118명 중 47명(39.83%), 위약 투여군 60명 중 9명(15%)이 TI를 충족하며 통계적 유의성을 확보했다.
2차 평가지표 중 24주 TI를 기록한 환자의 비율은 투여군과 위약군 각각 27.97%(33명)와 3.33%(2명)를 기록했다. 이메텔스타트 투여군 중 24주 TI 환자의 수혈 중단 지속기간 중앙값은 약 80주였다.
이메텔스타트 투여군의 안전성도 확인했다. 효능 부족으로 인한 치료 중단율은 이메텔스타트 투여군 23.7% 위약군 42.4%를 기록했다.
긍정적인 3상 결과를 기반으로 제론은 올해 중순 미국 식품의약국(FDA) 및 유럽의약품청(EMA)에 각각 품목허가를 신청할 계획이다. 미국에서 내년 상반기, 유럽에서 내년 말 출시를 목표하고 있다.
이메텔스타트는 제론이 악성 혈액암 치료제로 개발 중인 텔로머라아제 억제제다. 비임상 연구 결과 골수성 악성 혈액암에서 악성 줄기세포 및 전구세포의 증식을 억제하는 것을 확인했다.
업계에서는 에스티팜이 이메텔스타트의 주요 원료인 올리고뉴클레오타이드를 제론에 공급 중인 것으로 보고 있다.
에스티팜은 2021년 9월 올리고핵산 치료제 신약의 임상 3상용 원료의약품 공급 계약에 대해 공시했다. 180억원 규모다.
공시에 따르면 이 계약은 혈액암을 적응증으로 글로벌 임상 3상이 진행 중인 올리고핵산 치료제의 원료의약품 총 5배치를 공급하는 내용이다. 품목허가 신청을 위해 필요한 상업화 규모 시험생산(PPQ) 3배치를 포함한다. 이 신약의 글로벌 3상 결과는 2023년 초에 발표될 예정이라고 했다. 상대방은 미국 바이오텍이며, 경영상 비밀 유지 등을 위해 기업명은 공개하지 않았다.
에스티팜 관계자는 ”이 상대방과 상업화 물량에 대한 원료 초도물량 공급계약도 이미 체결했다“며 ”승인 일정을 고려하면 올 하반기부터 공급이 시작될 것으로 기대하고 있다“고 말했다. 초도 공급량은 규모가 작아 공시하지 않았다는 설명이다.
제론이 품목허가를 받는다면 올리고핵산 의약품은 영역을 더 넓히게 된다. 올리고핵산 치료제는 뒤시엔 근이영양증 등 희귀질환에서 고지혈증과 같은 만성질환으로 사용 범위를 확장해왔다. 이메텔스타트로 항암 분야 진입을 앞두고 있다.
박인혁 기자 hyuk@hankyung.com
제론은 이메텔스타트의 골수이형성증후군 임상 3상 결과, 주요 유효성 평가지표를 충족했다고 4일(현지시간) 밝혔다. 올해 미국과 유럽에서 품목허가 신청을 예고했다. 승인받으면 첫 올리고핵산 항암제가 된다. 제론의 주가는 32.92% 급등했다.
제론은 재발성 및 불응성 또는 적혈구 생성자극제(ESA)에 부적격인 저위험 MDS 환자를 대상으로 임상 3상을 진행했다. 1차 유효성 평가지표는 8주 수혈 독립성(transfusion independence, TI)이다. 치료 기간 중 8주 연속으로 적혈구 수혈을 받지 않은 환자의 비율을 의미한다. 이메텔스타트 투여군 118명 중 47명(39.83%), 위약 투여군 60명 중 9명(15%)이 TI를 충족하며 통계적 유의성을 확보했다.
2차 평가지표 중 24주 TI를 기록한 환자의 비율은 투여군과 위약군 각각 27.97%(33명)와 3.33%(2명)를 기록했다. 이메텔스타트 투여군 중 24주 TI 환자의 수혈 중단 지속기간 중앙값은 약 80주였다.
이메텔스타트 투여군의 안전성도 확인했다. 효능 부족으로 인한 치료 중단율은 이메텔스타트 투여군 23.7% 위약군 42.4%를 기록했다.
긍정적인 3상 결과를 기반으로 제론은 올해 중순 미국 식품의약국(FDA) 및 유럽의약품청(EMA)에 각각 품목허가를 신청할 계획이다. 미국에서 내년 상반기, 유럽에서 내년 말 출시를 목표하고 있다.
이메텔스타트는 제론이 악성 혈액암 치료제로 개발 중인 텔로머라아제 억제제다. 비임상 연구 결과 골수성 악성 혈액암에서 악성 줄기세포 및 전구세포의 증식을 억제하는 것을 확인했다.
업계에서는 에스티팜이 이메텔스타트의 주요 원료인 올리고뉴클레오타이드를 제론에 공급 중인 것으로 보고 있다.
에스티팜은 2021년 9월 올리고핵산 치료제 신약의 임상 3상용 원료의약품 공급 계약에 대해 공시했다. 180억원 규모다.
공시에 따르면 이 계약은 혈액암을 적응증으로 글로벌 임상 3상이 진행 중인 올리고핵산 치료제의 원료의약품 총 5배치를 공급하는 내용이다. 품목허가 신청을 위해 필요한 상업화 규모 시험생산(PPQ) 3배치를 포함한다. 이 신약의 글로벌 3상 결과는 2023년 초에 발표될 예정이라고 했다. 상대방은 미국 바이오텍이며, 경영상 비밀 유지 등을 위해 기업명은 공개하지 않았다.
에스티팜 관계자는 ”이 상대방과 상업화 물량에 대한 원료 초도물량 공급계약도 이미 체결했다“며 ”승인 일정을 고려하면 올 하반기부터 공급이 시작될 것으로 기대하고 있다“고 말했다. 초도 공급량은 규모가 작아 공시하지 않았다는 설명이다.
제론이 품목허가를 받는다면 올리고핵산 의약품은 영역을 더 넓히게 된다. 올리고핵산 치료제는 뒤시엔 근이영양증 등 희귀질환에서 고지혈증과 같은 만성질환으로 사용 범위를 확장해왔다. 이메텔스타트로 항암 분야 진입을 앞두고 있다.
박인혁 기자 hyuk@hankyung.com