"다국적 제약사 신약, 국내 허가 걸리는 시간 점차 늘어"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
다국적 제약사의 신약이 국내 허가·심사에 걸리는 기간이 점차 늘어나는 것으로 나타났다.
한국글로벌의약산업협회(KRPIA)는 2011년부터 2020년까지 10년간 다국적 제약사의 신약 235개를 조사한 결과 국내 허가·심사에 걸리는 기간이 평균 314일로 나타났으며, 이는 2008년부터 2017년까지 평균 기간인 300일보다 2주 늘어난 것이라고 16일 밝혔다.
허가에 걸리는 시간은 2015년 이후 꾸준히 증가하는 추세라고 협회는 설명했다.
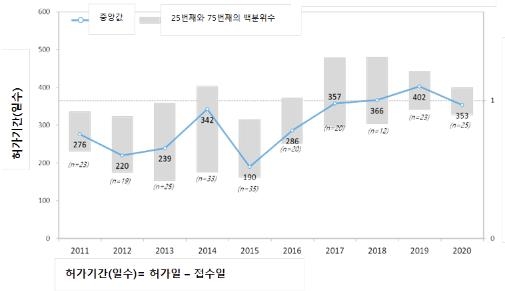
다만 2015년 희귀의약품 개발 촉진을 위한 희귀질환관리법이 제정됐음에도 이에 따라 별도의 희귀의약품 지정 절차가 생기며 오히려 허가와 심사에 걸리는 기간이 늘어난 것으로 분석됐다.
허가·심사 과정에는 의약품 제조 및 품질관리 기준(GMP) 심사 기간이 허가 기간을 늘리는 주요 원인으로 나타났다.
특히 GMP 현지 실사 여부와 일정을 정하는 것이 영향을 준 것으로 나타났다.
한편 2020년에는 허가심사 기간이 전년 대비 감소한 것으로 나타났는데, 이는 코로나19로 제조소 현지 실사가 면제된 것이 원인으로 보인다고 협회는 설명했다.
협회는 "2021년 약사법이 개정되면서 우선심사·조건부 허가와 같은 신속허가·심사 제도의 개선을 위한 여러 노력이 있었다"며 "허가 소요 기간 단축을 위해서는 심사 부서의 전문 인력 확충, 관련 규정의 국제조화 및 외국 규제 기관과의 협력 강화, 상호 인증 제도의 확대 등 지속적인 노력이 필요하다"고 말했다.
이번 조사는 이재현 성균관대학교 약학대학 교수가 수행했으며 연구 결과는 국제학술지 '치료 혁신 및 규제과학'에 실렸다.
/연합뉴스
-
기사 스크랩
-
공유
-
프린트




![뉴욕증시, PCE 대기하며 강보합...네이버웹툰 10%↑ [출근전 꼭 글로벌브리핑]](https://timg.hankyung.com/t/560x0/photo/202406/B20240628062256643.jpg)







![[오늘의 arte] 티켓 이벤트, 짐 아비뇽: 21세기 스마일 展](https://timg.hankyung.com/t/560x0/photo/202406/AA.37183633.3.jpg)