바이젠셀 "고형암 CAR-T를 시작으로 본격적인 도약 나설 것"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
김태규 대표 인터뷰
"종합 세포유전자치료제 신약 벤처되겠다"
"종합 세포유전자치료제 신약 벤처되겠다"

지난 17일 만난 김태규 바이젠셀 대표(사진)는 “지난해 준공한 세포치료제 생산시설은 임상을 진행 중인 후보물질과 이후 승인받을 제품의 생산으로 완전가동이 가능할 것으로 기대하고 있다”고 말했다.
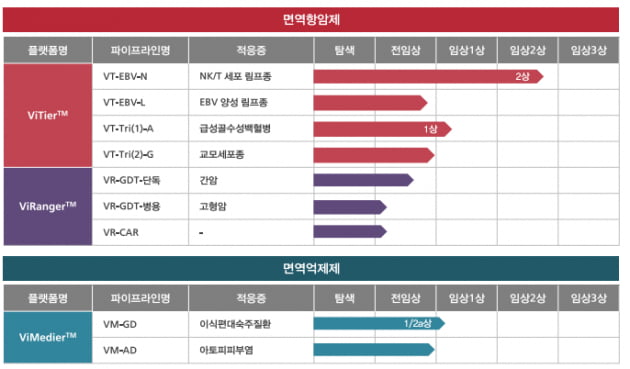
고형암 표적 자가 CAR-T, 6월 공개
2023년 가장 빨리 가시화될 성과로는 고형암을 표적하는 자가 CAR-T 치료제를 꼽았다. 지난해 11월 미국 보스턴에서 열린 미국면역항암학회(SITC)에서 CD30 기반 신호전달 도메인(부위)을 공개했다. 오는 6월 이 신호전달 도메인을 이용한 고형암 CAR-T를 공개한다는 계획이다. 바이젠셀이 고형암 CAR-T에 대한 개발 일정을 공개한 건 이번이 처음이다.현재까지 출시된 CAR-T 치료제는 6종으로 모두 혈액암 치료 목적으로만 쓰이고 있다. 노바티스의 '킴리아'와 길리어드의 '예스카타' 등이 대표적이다. 하지만 혈액암이 아닌 대다수 암, 즉 고형암에서는 CAR-T가 제대로 된 실력발휘를 하지 못하고 있다.
암항원이 명확한 혈액암과 달리 고형암에선 CAR-T가 표적할 항원이 불분명한 점이 개발에 있어 가장 어려운 점으로 꼽힌다. MD앤더슨암센터가 투자해 설립한 인벡티스(Invectys)와 바이오엔텍 등이 고형암을 대상으로 임상 1/2상을 진입해 선두 그룹으로 꼽히나 아직 효능과 안전성 입증까지는 갈 길이 먼 상태다.
김 대표는 “CAR-T 치료제가 혈액암에서는 훌륭한 역할을 하고 있지만, 고형암에서 효과를 낸 사례는 드물다”며 “고형암에서의 실패 사례를 분석해 성공 가능성이 높은 전략을 공개하겠다”고 말했다.
바이젠셀의 CAR-T는 신호전달 도메인으로 기존 CD28, 4-1BB 대신 독자 개발한 CD30을 이용하기 때문에 특허 문제에서도 자유롭다는 게 회사 측 설명이다. 신호전달 도메인과 관련된 지적재산권 문제는 CAR-T 업계에서 언제 터질지 모르는 '지적재산권 폭탄'이라는 평가를 받고 있다. 매출이 증가하게 되면 유전자치료제를 전달하는 지질나노입자(LNP)처럼 언제든 관련 소송으로 번질 수 있다.
김 대표는 “CD30 신호전달 도메인이 동물모델에서 제대로 작동하는 지에 대한 개념증명(POC)은 작년 SITC에서 공개했고, 오는 6월엔 구체적인 실행계획을 공유할 것”이라고 했다. CAR-T가 표적하는 암항원과 환자를 선별하기 위한 바이오마커 등을 공개할 것으로 업계는 보고 있다.
감마델타 T세포 치료제, 내년 임상 진입
바이젠셀이 CAR-T 및 감마델타 T세포 치료제 개발에 나서는 이유는 최종 목적지인 감마델타 CAR-T 치료제를 위해서다.세포독성 T세포는 알파 베타 감마 델타 등 4종류가 있다. 이 중 알파·베타 T세포는 수도 많고(약 90%) 분리와 배양이 용이해 CAR-T 치료제에 사용된다. 하지만 면역 거부 반응이 생겨 별도의 유전자조작을 하지 않는다면 자가 이식만 가능하다. CAR-T를 환자에게서 채취한 T세포로 만드는 이유다.
감마·델타 T세포는 반대다. 전체 세포독성 T세포 중에서 숫자가 적고 분리도 어렵다. 특히 체외 배양이 까다롭다. 하지만 다른 사람의 몸에서도 면역반응을 일으키지 않는다는 장점이 있다. 대량으로 미리 생산해 치료가 필요한 환자들에게 투약하는 ‘기성품’ 세포치료제로 쓸 수 있는 것이다. 동종 T세포를 이용한 기성품은 CAR-T 치료제의 최종 목적지로 여겨진다.
김 대표는 “감마델타 T세포 치료제는 배양 기술 특허 등을 기반으로 현재 공정개발 단계에 있다”며 “대량 생산이 안정화되면 내년 하반기엔 임상시험계획서(IND)를 식품의약품안전처에 제출할 수 있을 것”이라고 말했다. 이어 “국내에서 감마델타 T세포 치료제로 임상에 진입하는 첫 신약벤처가 될 것”이라고 했다.
감마델타 T세포 치료제의 글로벌 경쟁은 아직 승자가 없는 상황이다. 미국 에디셋바이오와 인에이트바이오, 싱가포르 사이토메드테라퓨틱스 등 소수 기업이 초기 임상에 진입했다. 비호지킨 림프종(NHL) 등 주로 혈액암을 대상으로 임상을 신청했으며, 교모세포종 등 고형암 대상 전임상시험도 진행되고 있다. 바이젠셀은 감마델타 T세포 치료제를 먼저 상용화한 뒤 CAR 유전자를 더한 감마델타 CAR-T를 이어서 개발한다는 계획이다.
NK/T 림프종 2상서 효능 입증 '주목
바이젠셀의 선도 파이프라인(후보물질)은 NK/T 림프종 재발을 막기 위한 T세포 치료제 ‘VT-EBV-N’이다. 임상 2상 중이다.VT-EBV-N는 앱스테인바 바이러스(EBV)에 감염돼 발생하는 암세포를 공격한다. VT-EBV-N은 화학요법 및 방사선요법으로 암세포를 완전히 제거한(완전관해) 환자에게서 재발이 일어나지 않도록 하는 예방 목적으로 개발되고 있다.
앞선 임상에서 VT-EBV-N를 투약한 환자들의 5년 무진행생존율(PFS)은 90%를 기록했다. 암세포가 사라진 환자 10명 중 9명에서 5년 간 암이 재발하지 않았다는 뜻이다. NK/T 림프종 환자의 재발 비율은 75% 정도다. 바이젠셀은 임상 2상에서 2년 간 추적조사를 통해 위약군과 비교해 VT-EBV-N의 효능을 재입증한다는 계획이다. 최종 결과는 2026년에 확인할 수 있을 것으로 예상된다.
지난해 10월 식약처에서 임상 1상을 승인받은 'VT-Tri(1)-A'도 암 재발 예방 목적의 세포치료제다. 급성골수성백혈병(AMD) 환자를 대상으로 1상이 허가됐다. 김 대표는 “앞서 진행한 응급임상과 연구자 주도 임상(IIT) 결과가 긍정적이었기 때문에 좋은 결과를 예상한다”고 말했다.
VT-EBV-N와 VT-Tri(1)-A는 바이젠셀의 ‘바이티어(ViTier)’ 플랫폼 기술을 적용한 T세포 치료제다. T세포가 최대 3개 암 항원을 인식할 수 있도록 교육했다. 바이티어는 암의 재발을 막는 데 초점이 맞춰져 있다. 간암 환자에서 종양을 제거한 뒤 예방 목적으로 사용하는 지씨셀의 세포치료제 ‘이뮨셀LC’와 개념적으로 유사하다. 자가세포 치료제인 이뮨셀LC의 회당 투약 비용은 900만원 정도다. 수 차례 반복투여하기 때문에 환자 1명당 매출이 크다. 지난해 3분기 누적 매출은 231억원이었다.
국내에서 일곱 번째로 환자가 많은 간암과 달리 NK/T세포 림프종은 희귀암이다. 환자 수 부족으로 VT-EBV-N 2상의 환자 모집에도 어려움을 겪고 있다. 임상 기간이 늘어질 수 있고, 일각에선 승인을 받더라도 VT-EBV-N가 큰 매출을 일으키긴 어려울 것이란 관측도 나온다.
VT-EBV-N 임상 2상 결과는 바이티어 플랫폼의 효과를 확인한다는 데 의미가 크다고 김 대표는 강조했다. 그는 “EBV가 원인이 되는 암은 환자가 많은 위암 등 다양하다”며 “VT-EBV-N의 2상에서 효능이 입증되면 다양한 암종에 바이티어 플랫폼 기반 세포치료제를 적용할 수 있을 것”이라고 말했다.



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


