美 넥타, 자가면역질환 임상도 실패…IL-2 또 다시 고배
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
[이우상의 글로벌워치] 일라이릴리 개발 포기
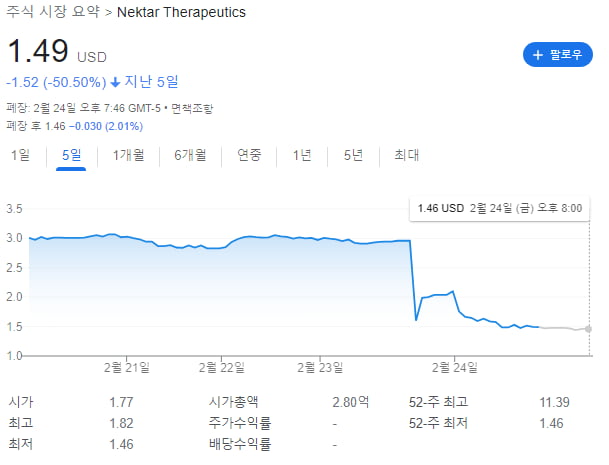
IL-2로 만든 루프스병 치료제 후보물질의 임상 2상 결과, 1차 평가지표를 충족하지 못했다. 공동 개발 협력사였던 일라이릴리는 루프스병에 대한 임상 3상을 하지 않겠다고 밝혔다. 임상 실패 소식이 전해진 지난 24일(미국 시간) 넥타의 주가는 50% 가까이 폭락했다.
이달 23일 넥타가 발표한 임상 2상(NCT04433585)의 주요(톱라인) 결과에 따르면 레즈펙은 임상시험 성공 여부를 가리는 1차 평가지표를 만족하지 못했다.
임상에는 중등증~중증 전신성 홍반성 루프스병 환자 291명이 참여했다. 1차 평가지표는 전신성 홍반성 루푸스 질병 활동 지수(SLEDAI)의 4점 이상 변화였다. SLEDAI는 2002년 도입된 평가지표로 0~105점이며, 점수가 높을수록 상태가 심각하다. 넥타가 4점 이상 감소를 1차 평가지표로 설정한 까닭은 임상적으로 4점 이상 개선됐을 때 ‘의미 있는 개선’으로 평가하기 때문이다. 환자들은 저용량과 중간 용량, 대용량의 레즈펙 또는 위약(가짜약)을 투약받았다.
하지만 환자의 증상 개선 정도를 보는 SLEDAI 점수는 바이오마커 값과 다르게 움직였다. 투약한 환자 중 8.8%만이 4점 이상의 증상 개선 효과를 보였다. 넥타 관계자는 “저용량 또는 고용량 대비 중간 용량에서 반응이 가장 좋았으며, 중간 용량에서 위약 대비 수치적 개선을 보여줬다”면서도 “위약과 비교해 유의미한 유의성을 보이지 못해 1차 평가지표 달성에 실패했다”고 설명했다.
넥타는 레즈펙의 부작용이 경미하거나 중등도였다고 보고했다. 치료 중단율은 위약에서 12%였으며 저용량 24%, 중간 용량 19%, 고용량 40%였다.
벰펙에 이어, 레즈펙의 임상 결과 또한 기대에 미치지 못하면서 투자자들의 관심은 넥타가 보유한 나머지 후보물질로 옮겨가고 있다.
넥타는 IL-2 대신 인터루킨-15(IL-15)를 엔지니어링해 만든 후보물질 ‘NKTR-255’을 개발하고 있다. 거대 B세포 증후군(LBCL)을 적응증으로 CAR-T(키메릭항원수용체 T세포) 치료제 ‘예스카타’ 및 ‘브레얀지’와 병용하는 임상이 현재 2·3상으로 가장 앞서 있다. 방광암 치료를 목적으로 바벤시오와 병용하는 임상은 2상 단계에 있다.
이우상 기자 idol@hankyung.com
**이 기사는 바이오·제약·헬스케어 전문 사이트 <한경 BIO Insight>에 2023년 2월 27일 13시 22분 게재됐습니다.



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


