티움바이오, AACR서 ‘TU2218’ 전임상 결과 2건 발표
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
쥐모델에 CTRL4과 병용투여
완전관해율 대장암 75%·섬유육종 80%
완전관해율 대장암 75%·섬유육종 80%
티움바이오는 면역항암제 후보물질 ‘TU2218’의 전임상 결과 2건을 2023년 미국암연구학회(AACR)에서 발표했다고 19일 밝혔다.
티움바이오는 TU2218를 전환성장인자베타-수용체1(TGF-β R1)과 혈관내피성장인자-수용체2(VEGF-R2)를 동시에 저해하는 계열 내 최초(First-in-class) 약물로 개발 중이다.
미국 식품의약국(FDA) 및 국내 식품의약품안전처로부터 임상 1·2상 시험을 승인받고 단독 투여 및 키트루다와의 병용 투여 임상을 진행 중이다.
티움바이오는 대장암 및 섬유육종 동종 종양모델에 TU2218를 CTLA4 저해제와 병용투여했다. 그 결과 완전관해율(CR)이 각각 75%와 80%를 기록했다고 전했다. 약물 투여 중단 후에도 지속적으로 항암 효과가 관찰됐다고 했다.
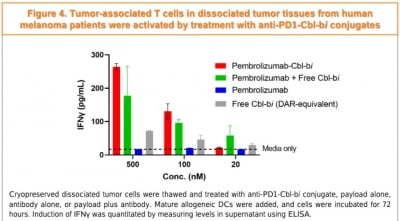
TU2218이 면역관문억제제에 유리한 종양미세환경을 조성하고 종양침윤림프구(TIL)를 정상화한 것을 확인한 연구 결과도 공개했다. 면역이 결핍된 흑색종 모델(b16f10)에서 TU2218과 PD-1 저해제를 병용 투여했을 때 PD-1저해제 단독 투여 대비 암 성장이 억제됐다는 것이다.
이를 통해 TU2218이 T세포 수치를 높이고 PD-1 요법에 유리한 면역환경으로의 전환을 유도하는 것을 입증했다고 티움바이오 측은 전했다.
티움바이오 관계자는 “PD-1 저해제뿐 아니라, CTLA4 저해제와의 우수한 시너지 효과를 입증한 것은 고무적인 결과”라며 “올해부터 임상결과 발표가 순차적으로 예정돼 있어 주요 글로벌 학회를 통해 지속적으로 발표할 예정”이라고 말했다.
박인혁 기자 hyuk@hankyung.com
티움바이오는 TU2218를 전환성장인자베타-수용체1(TGF-β R1)과 혈관내피성장인자-수용체2(VEGF-R2)를 동시에 저해하는 계열 내 최초(First-in-class) 약물로 개발 중이다.
미국 식품의약국(FDA) 및 국내 식품의약품안전처로부터 임상 1·2상 시험을 승인받고 단독 투여 및 키트루다와의 병용 투여 임상을 진행 중이다.
티움바이오는 대장암 및 섬유육종 동종 종양모델에 TU2218를 CTLA4 저해제와 병용투여했다. 그 결과 완전관해율(CR)이 각각 75%와 80%를 기록했다고 전했다. 약물 투여 중단 후에도 지속적으로 항암 효과가 관찰됐다고 했다.
TU2218이 면역관문억제제에 유리한 종양미세환경을 조성하고 종양침윤림프구(TIL)를 정상화한 것을 확인한 연구 결과도 공개했다. 면역이 결핍된 흑색종 모델(b16f10)에서 TU2218과 PD-1 저해제를 병용 투여했을 때 PD-1저해제 단독 투여 대비 암 성장이 억제됐다는 것이다.
이를 통해 TU2218이 T세포 수치를 높이고 PD-1 요법에 유리한 면역환경으로의 전환을 유도하는 것을 입증했다고 티움바이오 측은 전했다.
티움바이오 관계자는 “PD-1 저해제뿐 아니라, CTLA4 저해제와의 우수한 시너지 효과를 입증한 것은 고무적인 결과”라며 “올해부터 임상결과 발표가 순차적으로 예정돼 있어 주요 글로벌 학회를 통해 지속적으로 발표할 예정”이라고 말했다.
박인혁 기자 hyuk@hankyung.com