급성 호흡기 질환 예방…RSV 백신시대 열렸다
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
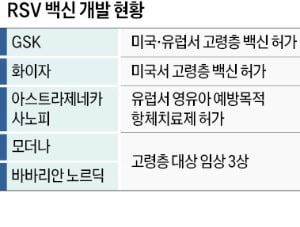
GSK·화이자 백신 시판 허가 받아
FDA, 60세 이상 성인용으로 승인
1회 투여 가격 60~185달러 선
감염땐 폐렴·기관지염 발전 가능성
NIH의 새로운 표적 제시가 전환점
美 모더나도 RSV 개발 속도
화이자, 임신부 대상으로 임상 확대
사노피 등 예방용 항체 치료제 개발
FDA, 60세 이상 성인용으로 승인
1회 투여 가격 60~185달러 선
감염땐 폐렴·기관지염 발전 가능성
NIH의 새로운 표적 제시가 전환점
美 모더나도 RSV 개발 속도
화이자, 임신부 대상으로 임상 확대
사노피 등 예방용 항체 치료제 개발

○美 FDA, 첫 RSV 백신 시판 허가
13일 의료계에 따르면 지난달 GSK의 아렉스비가 미 FDA의 시판 허가를 받은 데 이어 화이자의 애브리스보도 허가 관문을 넘었다. 만 60세 이상 고령층을 대상으로 시판 허가를 받은 RSV 백신은 두 개로 늘었다.포문을 연 것은 아렉스비다. 이 제품 승인을 결정한 피터 마크 FDA 생물의약품평가연구센터장은 “고령층과 심장·폐 질환자 등은 RSV로 심각한 질환에 걸릴 위험이 높다”며 “첫 백신이 승인된 것은 공중 보건 분야 중요한 성과”라고 평가했다.
RSV 감염은 주로 가을부터 겨울에 늘어난다. 고령층이 이 바이러스에 감염되면 폐렴이나 기관지염 등으로 이어질 위험이 높다. 미국 질병통제예방센터(CDC)에 따르면 매년 미국에서 이 질환으로 만 65세 이상 성인 6만~12만 명이 입원 치료를 받는다. 사망자도 6000~1만 명 정도로 비교적 많다. 국내에서 RSV 감염으로 생긴 폐렴 때문에 진료받은 환자는 지난해 기준 1만7330명이었다. 국내 환자는 대부분 영유아였다.
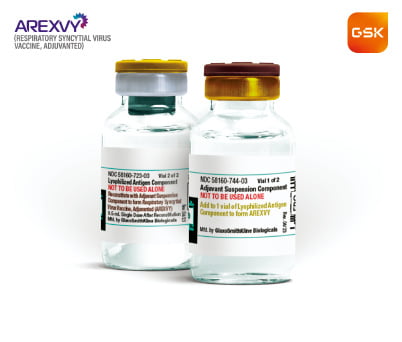
GSK는 아직 구체적인 가격을 공개하지 않았지만 앞서 독감이나 대상포진 백신처럼 1회 투여에 60~185달러 수준이 될 것이라고 언급하면서 업계에선 120달러 정도에서 가격이 정해질 것으로 내다봤다. 화이자도 곧이어 FDA의 시판 허가를 받았다. FDA는 3만7000명을 대상으로 한 임상시험 결과를 검토해 백신 허가를 결정했다. 하기도 감염 예방 효과는 66.7%, 중증질환 보호 효과는 85.7%였다. 백신 가격은 아직 공개되지 않았다.
○백신 개발 전환점 마련한 2013년 NIH 연구
이전에도 많은 연구자가 RSV의 F단백질에 초점을 맞춰 백신을 개발했다. NIH는 해당 단백질이 사람 세포와 융합하기 전 모양을 표적으로 삼아 백신을 개발하면 면역 반응을 높일 수 있다고 제안했다. 사람 세포와 융합하는 과정에서 단백질 모양이 바뀌기 때문이다.
이전까진 불안정성 때문에 융합 전 F단백질의 구조를 제대로 파악하지 못했다. 하지만 NIH는 융합 전 모양으로 F단백질 구조를 유지하는 방법을 찾아 공개했다. 해당 단백질을 표적으로 삼으면 중화항체가 50배 높아진다는 것도 입증했다. 이런 단백질 구조를 분석하는 접근법은 이후 코로나19 백신 개발에도 유용하게 활용됐다는 게 전문가들의 평가다.
○모더나도 대기…시장 규모만 100억달러
GSK와 화이자는 이런 융합 전 F단백질을 표적으로 삼았다. 이들 두 회사의 뒤를 바짝 쫓고 있는 미국 바이오기업 모더나와 덴마크 바바리안노르딕도 마찬가지다. GSK와 화이자에 이어 모더나까지 RSV 백신을 출시하면 세계 시장 규모가 100억달러에 이를 것으로 업계에선 평가했다.화이자는 백신 임상 대상을 임신부로 확대하고 있다. 임신 중일 때 백신을 맞은 뒤 신생아 감염을 예방하는 방식이다. 올해 8월께 시판 허가 여부가 결정될 것으로 예상된다. GSK도 비슷한 임상시험을 설계했지만 지난해 2월 안전성 문제를 고려해 임상시험 중단 결정을 내렸다. 화이자가 허가받으면 태아 예방 목적으로 임신부에게 투여하는 첫 RSV 백신이 된다.
모더나도 올해 상반기 RSV 백신 허가를 신청할 것으로 예상된다. 바바리안노르딕은 올해 중반께 성인 대상 임상 3상 시험 결과를 낼 수 있을 것이란 평가다.
영국 아스트라제네카와 프랑스 사노피는 RSV 예방용 항체 치료제인 니르세비맙을 개발하고 있다. 신생아와 영유아에게 RSV 감염증이 발생하는 것을 막는 목적으로 투여하는 항체치료제다. 유럽에선 시판 허가를 받았다. 미 FDA 승인은 올해 3분기께 받을 것으로 예상된다. 사전 검토기구인 FDA 자문위원회는 이 치료제 허가를 권고했다. 신생아와 영유아용으로 개발되는 제품군 가운데 가장 빠른 속도다. 국내 기업 중엔 SK바이오사이언스와 유바이오로직스 등이 개발에 뛰어들었지만 임상시험에 들어간 제품은 없다.
이지현 기자 bluesky@hankyung.com


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


