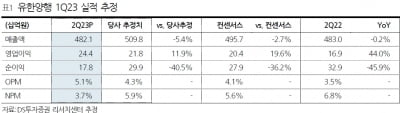
GC녹십자, 혈액제제 ‘GC5107B’ 美품목허가 심사 시작
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
내년 1월 13일까지 허가 여부 결정
GC녹십자는 미국 식품의약국(FDA)이 정맥투여용 면역글로불린제제 ‘GC5107B’(정맥투여용 면역글로불린10%)에 대한 품목허가(BLA) 심사를 시작했다고 31일 밝혔다.
FDA는 처방의약품신청자비용부담법(PDUFA)에 따라 내년 1월 13일(현지시간)까지 GC5107B의 최종 허가 여부를 결정할 예정이다.
GC5107B는 선천성 면역결핍증에 사용되는 혈액제제다. 코로나19 기간 FDA의 현장 실사가 불가능해 품목허가 심사가 늦어졌다. GC녹십자는 충청북도 오창의 혈액제제 생산시설에 대한 현장 실사를 지난 4월 받았다. 이를 기반으로 지난 14일 BLA를 재제출했다.
GC녹십자는 FDA로부터 GC5107B의 최종 허가를 받은 후 내년 미국 시장에 출시하겠다는 목표다. ‘알리글로’ 브랜드로 사업화할 계획이다.
박인혁 기자 hyuk@hankyung.com
FDA는 처방의약품신청자비용부담법(PDUFA)에 따라 내년 1월 13일(현지시간)까지 GC5107B의 최종 허가 여부를 결정할 예정이다.
GC5107B는 선천성 면역결핍증에 사용되는 혈액제제다. 코로나19 기간 FDA의 현장 실사가 불가능해 품목허가 심사가 늦어졌다. GC녹십자는 충청북도 오창의 혈액제제 생산시설에 대한 현장 실사를 지난 4월 받았다. 이를 기반으로 지난 14일 BLA를 재제출했다.
GC녹십자는 FDA로부터 GC5107B의 최종 허가를 받은 후 내년 미국 시장에 출시하겠다는 목표다. ‘알리글로’ 브랜드로 사업화할 계획이다.
박인혁 기자 hyuk@hankyung.com
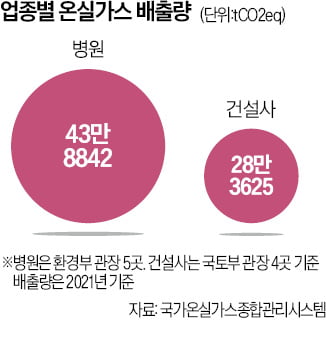


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


