바이오니아 자회사 써나젠, 폐섬유증藥 호주 1상 계획 승인
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
siRNA 치료제
건강한 성인 24명 대상 단회 투여
건강한 성인 24명 대상 단회 투여
임상 1a상은 건강한 성인 24명을 대상으로 15~210mg의 SRN-001 혹은 위약을 무작위 투여한다. 저용량군부터 단회 투여한 후 이상반응이 없으면 다음 용량군을 투여하는 방식으로 약물의 혈중 농도 및 투여량 범위를 확인한다.
써나젠은 호주 임상기관 CMAX를 통해 올해 연말까지 임상 1a상을 마치겠다는 목표다. 내년에는 미국 식품의약국(FDA)에 건강한 사람을 대상으로 반복투여하는 임상 1b상 및 환자 대상 2a상을 신청할 계획이다.
박한오 바이오니아 회장은 “선천면역을 자극해 염증 반응을 일으키는 부작용이 없다는 것이 사람에서도 확인되면 siRNA 신약 개발에서 새 역사를 쓰게 될 것”이라고 강조했다.
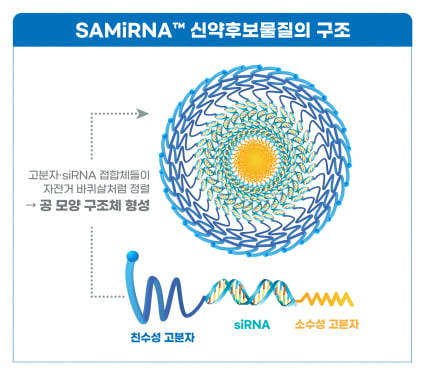
SRN-001은 질병 유발 mRNA를 분해시켜 근원 치료를 목표하는 짧은간섭RNA(siRNA) 유전자치료제다. SRN-001은 엠피레귤린(Amphiregulin, AREG) mRNA를 분해하는 siRNA를 써나젠의 물질특허 구조체인 SAMiRNA에 적용했다. AREG는 섬유화에 관여하는 성장인자다.
SAMiRNA는 siRNA에 친수성 및 소수성 고분자를 RNAi의 양쪽 끝에 접합시킨 구조체다. siRNA가 인체에서 분해되지 않고 표적 세포까지 전달되도록 하는 기술이다. 물질이 구 모양으로 뭉쳐질 때 물을 좋아하는 성질의 분자가 바깥쪽으로 감싸 siRNA를 보호한다.
SRN-001은 인간 말초혈액 단핵세포 실험과 범부처신약개발사업단의 지원을 받아 섬유증 모델 동물실험 및 설치류 영장류 독성시험 등을 수행했다. 그 결과 폐 및 신장 조직의 섬유화를 효과적으로 억제하고 정맥 투여 시 부작용을 유발하지 않았다. IPF에 대한 전임상 연구에서는 우수한 안전성 및 폐 기능 개선 가능성을 확인했다.
시장조사기관 리서치앤마켓은 2030년 기준 IPF 시장이 61억달러(약 8조 원) 규모로 커질 것으로 전망했다.
박준영 써나젠 대표는 “코로나19와 폐섬유증의 연관성이 큰 만큼 IPF 환자 증가세와 치료제 시장 성장세는 더욱 거세질 것”이라며 “SRN-001 임상을 성공시켜 섬유증 환자들이 질병의 고통에서 벗어나도록 하겠다”고 말했다.
박인혁 기자 hyuk@hankyung.com

