젠큐릭스, 폐암 동반진단 태국 판매허가…동남아 시장 진출
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
‘드롭플렉스 EGFR 뮤테이션테스트 v2’
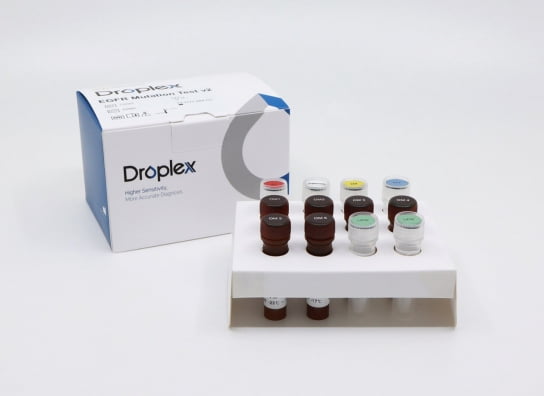
이 제품은 폐암 치료에서 개별 환자들에게 가장 적합한 표적치료제를 선택하는 데 사용되는 동반진단 검사 제품이다. 기존 V1 제품에서 대폭 성능을 개선해 지난 6월 국내 식품의약품안전처의 허가를 받았다. 태국뿐만 아니라 최근 아랍에미리트(UAE)와 콜롬비아에서도 허가를 받아 중동 및 중남미 시장 수출을 추진하고 있다.
회사에 따르면 이 제품은 디지털PCR 기술을 사용해 정확도를 크게 개선했다. 기존 실시간 유전자증폭(RT-PCR) 제품보다 두 배가 넘는 107개의 돌연변이를 검출할 수 있다. 특히 기존 제품과 달리 신약 출시로 주목받고 있는 ‘엑손20삽입(Exon 20 Insertions)’ 변이까지 정확히 검출해 낼 수 있다. 우수한 민감도 덕분에 조직 검체는 물론이고 혈액에서도 돌연변이를 검출할 수 있어, 치료 반응 모니터링에도 사용할 수 있다고 회사는 설명했다.
젠큐릭스의 동반진단 제품은 지난해 총 8개가 유럽 체외진단의료기기 인증(CE-IVD)을 획득했다. EGFR 검사 이외에도 대장암(KRAS), 갑상선암(BRAF) 검사가 국내 식약처 허가를 받았다. 자궁내막암 검사(POLE)도 현재 허가 심사가 진행 중이다. POLE 검사는 인도 국립암센터인 ‘타타 메디컬 센터’에도 정식 납품을 시작했다.
젠큐릭스는 국내외 허가 제품의 수가 늘어나고 도입 병원 수가 증가함에 따라, 동반진단 부문 매출도 지속적으로 성장할 것으로 보고있다.
젠큐릭스 관계자는 “드롭플렉스 동반진단 제품들에 대한 국내외 고객들의 관심이 높다”며 “국내외에서 계속해서 허가 절차가 완료되고 있어 이를 바탕으로 판매 증대를 더욱 적극적으로 추진할 것”이라고 말했다.
김예나 기자 yena@hankyung.com
ADVERTISEMENT
ADVERTISEMENT




![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


