뷰노, '뷰노메드 딥브레인' 美 FDA 인증 획득
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
‘510(k)’ 인증 획득
현지 법인 기반 영업 및 마케팅 본격화
현지 법인 기반 영업 및 마케팅 본격화
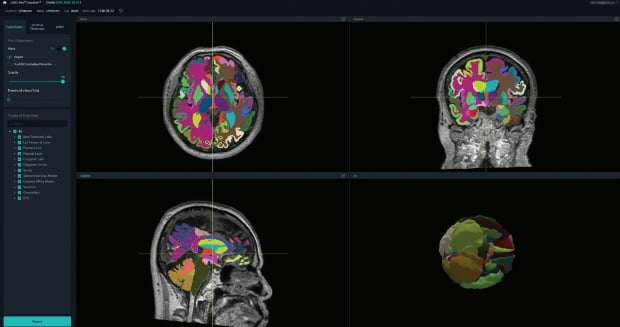
510(k)는 의료기기 시판 전 기존 인증 제품과 동등성을 비교해 성능이 안전하고 효과적이라는 것을 검증하는 FDA의 허가 제도다.
뷰노메드 딥브레인은 딥러닝을 기반으로 뇌 자기공명영상(MRI)을 분석해 뇌 영역을 100여개 이상으로 분할(Parcellation)하고, 각 영역의 위축 정도를 정량화한 정보를 1분 내 제공하는 AI 의료기기다.
이를 통해 의료진이 알츠하이머성 치매, 혈관성 치매 등 주요 퇴행성 뇌 질환으로부터 비롯되는 치매를 진단하는 것을 돕는다. 또 경도인지장애에서 치매로 진행할 가능성이 큰 환자를 미리 선별하는 데 기여할 수 있다.
뷰노는 이번 FDA 인증을 통해 미국 법인을 기반으로 현지 의료기관 대상 영업과 마케팅을 강화해 신속한 시장 진출을 도모할 계획이다. 또 올해 알츠하이머 치료제의 FDA 승인으로 치매 조기 진단 시장의 가파른 성장이 기대됨에 따라 AI 기반 뇌 MRI 정량화 기술에 수요가 있는 기업들과 협력을 적극적으로 확장할 방침이다.
앞서 뷰노는 임상 연구 결과를 통해 뷰노메드 딥브레인의 알츠하이머 조기 진단 가능성을 확인했다. 지난 7월 알츠하이머협회 국제 컨퍼런스(AAIC 2023)에서 발표한 임상 연구에 따르면 뷰노메드 딥브레인은 주관적 인지저하(SCD) 환자에서 알츠하이머를 진단할 수 있는 가능성을 제시했다.
이예하 뷰노 대표는 “뷰노의 첫 FDA 인증 제품인 뷰노메드 딥브레인은 다수의 글로벌 학회 및 학술지를 통해 우수한 임상적 유효성을 입증해 온 AI 의료기기로, 뷰노의 미국 시장 공략의 초석이 될 것”이라며 “최근 차세대 치매 치료제의 등장으로 조기 진단에 대한 수요가 높아짐에 따라, 해당 제품이 미국 시장에서 빠르게 확산할 수 있도록 영업을 강화하겠다”고 말했다.
김예나 기자 yena@hankyung.com


![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


