뉴로바이오젠 “비만·치매치료제 1상 성공…2분기 2상 신청할 것”
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
‘KDS2010’ 개발 및 1상 결과 설명회 개최
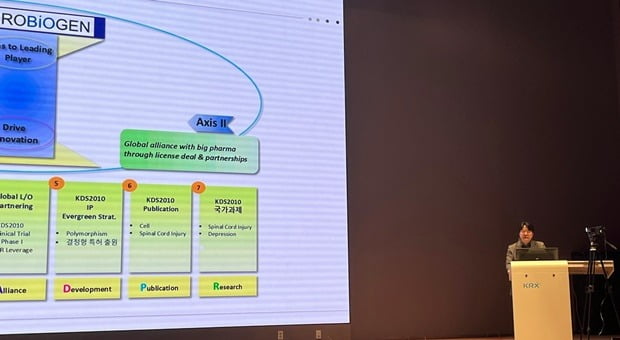
김상욱 뉴로바이오젠 대표는 19일 서울 여의도 한국거래소(KRX)에서 진행된 ‘KDS2010 개발 및 임상 1상 결과 설명회’에서 “KDS2010의 임상 1상을 성공적으로 마치고 오는 2분기에 국내 임상 2상을 신청할 것”이라며 이같이 말했다.
KDS2010은 뇌 속에 있는 신경세포 군집 ‘가브라파이브(가브라5)’를 조절한다. 뇌 속의 별 모양 세포에서 마오비 효소가 분비되면 신경 물질 가바가 합성되고 주변에 있는 가브라5 신경세포를 억제한다. 이에 지방 세포의 연소가 억제되고 비만이 발생한다.
KDS2010은 마오비 효소를 억제해 가브라5를 활성화한다. 이를 통해 비만 억제 스위치를 다시 켜 비만을 억제하는 기전이다. 식욕을 억제하는 기존의 비만 치료제와 달리 차별화된 기전이라는 게 회사 측의 설명이다.
뉴로바이오젠은 먹는(경구용) 약으로 KDS2010을 개발 중이다. 기존 피하주사 제형보다 복약 투약성이 뛰어나고 오심 구토 등 소화기계 부작용을 줄일 것으로 기대된다고 김 대표는 설명했다.
“국내 임상 2상서 미국인 코호트 포함 진행할 것”
뉴로바이오젠은 이날 KDS2010의 임상 1상 결과를 처음으로 공개했다. 발표는 임상 1상 책임자(PI)인 이승환 서울대병원 임상약리학과 교수가 맡았다. KDS2010 임상 1상은 내국인과 서양인(코카시안 계열) 88명을 대상으로 진행됐다.그는 “KDS2010은 1일 1회 용법에 적절한 약동학적 특성이 있고 반복 투여시 60~480mg 범위에서 용량-비례성을 확인했다”며 “약동학에 대한 식이 영향이 없음을 확인해 향후 임상에서 식사와 무관한 투여가 가능할 것”이라 말했다.
박은경 뉴로바이오젠 개발부장은 “KDS2010은 전임상에서 식욕억제를 하지 않으면서 효율적으로 최대 42%까지 체중을 감량하는 효과를 확인했다”며 “위고비(세마글루타이드), 젭바운드(티어제파타이드)와 직접 효능을 비교한 결과 효율적으로 높은 체중 감소 효능을 보였다”고 말했다.
임상 2상은 모두 국내에서 진행하지만 각 임상에서 한 개 코호트를 미국에서 대상자를 모집해 진행하겠다는 전략이다. 박 부장은 “앞서 임상 1상에서 서양인 환자에 대한 안전성을 확인해 2상에 미국인 코호트를 포함해 진행하는 것이 가능하다”며 “국내에서 해외 코호트를 결합해 임상을 진행하는 것은 처음일 것”이라고 말했다.
이와 함께 올 2분기에 미국 식품의약국(FDA)과의 임상 신청 전 사전회의(Pre-IND 미팅)를 진행할 예정이라고 회사 측은 전했다.
뉴로바이오젠은 KDS2010의 후속으로 대사이상 관련 지방간염(MASH), 염증성 장질환(IBD), 다발성경화증(MS), 근위축성 측삭경화증(ALS) 치료제 후보물질도 개발하고 있다.
김예나 기자 yena@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


