"中 우시 대체 가능 공장 전 세계 4곳 뿐…국내선 바이넥스 기대"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
정유경 신영증권 연구위원 '생물보안법의 진정한 수혜자'보고서
120개 품목, '우시'급 초기단계 대체 가능 AGC KBI 렌슬러 에비드 등 4곳
"바이넥스, 셀트 물량 FDA실사…40개 인증 경험으로 곧 中 대체 가능"
120개 품목, '우시'급 초기단계 대체 가능 AGC KBI 렌슬러 에비드 등 4곳
"바이넥스, 셀트 물량 FDA실사…40개 인증 경험으로 곧 中 대체 가능"
"생물보안법 단독으로 연내 통과 가능성 높아"
정유경 신영증권 연구위원은 최근 ‘생물보안법 진정한 수혜자’제목의 보고서에서 “이는 어디까지나 패스트트랙 절차이므로 NDAA에 포함되지 않았다 하더라도 생물보안법 단독으로 연내 통과 가능성은 매우 높은 상황”이라며 “NDAA 외 다른 입법 패키지에 포함될 가능성도 여전히 유효하다”고 밝혔다. 한 미국 현지 위탁개발생산(CDMO) 업체 대표도 “생물보안법은 미국 바이든 행정부가 강력하게 미는 법안으로 중국 우시그룹도 이 법안이 통과된다는 전제하에 각종 대응 시나리오를 짜고 있다”고 말했다. 미국바이오협회(BIO)의 힐러리 스티스 국제정책본부장도 최근 한국경제신문과의 인터뷰에서 “생물보안법은 조 바이든, 도널드 트럼프 등 누가 미국 대통령이 되든 꼭 통과돼 추진될 것”이라며 “미국 내 높은 반중 여론을 감안할 때 규제가 더 약해지긴 힘들 것”이라고 말했다. 그는 “미국 정보당국이 그 증거(중국 일부 바이오기업이 미국인의 건강·유전 정보를 빼돌렸다는 정황)를 갖고 있다”며 “미국 국민은 정부와 정치권이 중국에 대해 강한 모습을 보여주길 원한다”고 강조했다.생물보안법이 시행된다면 시장은 어떻게 달라질까. 전문가들은 당장 전 세계 제약·바이오업계의 신약 개발 지원 및 생산 공장 역할(CDMO)을 해온 우시바이오로직스, 우시앱텍텍 뿐만 아니라 중국 최대 유전체 회사인 BGI(베이징 게놈 연구소)와 자회사인 MGI, 미국 내 자회사인 컴플리트 지노믹스 등의 빈자리를 대체할 비(非) 중국계 기업에 주목하고 있다.
정유경 신영증권 연구위원은 “현재 생물보안법의 적용 대상인 컴플리트 지노믹스, 우시바이오로직스 등과 업무 관계를 맺고 있는 미국 회사들의 파이프라인(후보물질) 중 영향권에 있는 품목은 120개 이상으로 추산되고 있으며 이 중 절반 이상이 임상 단계에 해당되고 약 30%는 전임상 등 초기 단계에 해당하는 것으로 파악되고 있다”고 밝혔다. 실제 시중에 시판되는 상업화 제품 CDMO시장 보다 현재 임상 혹은 전임상 단계로 개발 중인 제품 CDMO 시장에서 교체 수요가 생길 것이란 관측이다. 상업화 단계 제품을 대량 생산하는 대형 CDMO보다 그 이전 단계 제품의 공정을 맡은 중소형 CDMO가 ‘수혜주’로 떠오르는 배경이다.
그는 “현재 버전의 하원 생물보안법(H.R. 8333)에서는 2031년 말 까지 약 7년의 유예기간을 부여하고 있으나 임상 2상 이상의 단계에서는 공정개발 등 제조공정개발(CMC)이 어느 정도 확립이 된 상황이므로 CDMO를 교체하는 것이 결코 쉬운 일이 아니며 추가 비용과 시간이 소요될 수 있어 생물보안법 시행 시 후기 개발 단계의 기업들은 상당한 어려움에 직면할 수 있다”라고도 했다.
특히 그는 “생물보안법에 저촉되는 품목을 공공기관인 CMS 산하의 메디케어, 메디케이드에서 취급(환급)할 수 없을 전망이므로 다수의 의약품을 보유한 글로벌 제약사는 생물보안법 적용 기업들과의 거래를 조기에 정리하려는 움직임도 구체화될 전망이다”라고 했다. 사실상 중국기업의 기술이 공정 과정에 들어간 제품의 판매가 원천 봉쇄될 수 있다는 의미다.
이미 머크, 길리어드, 버텍스파마와 같은 신약개발 기업은 비용 증가와 임상 지연을 우려하고 있어 벌써 다른 CDMO 기업을 찾으려는 움직임이 뚜렷해질 전망이다. 미국 BIO의 최근 설문조사 결과 124개 응답 기업의 79%가 중국 바이오기업과 거래하고 있다고 밝혔고 생물보안법 시행 후 기존 거래처를 바꾸는 데 8년이 걸릴 것으로 예상했다. 제약·바이오는 보통 계약이 5~7년 단위로 이뤄지기 때문에 사실 올해부터 새로운 거래처를 물색해야 한다.
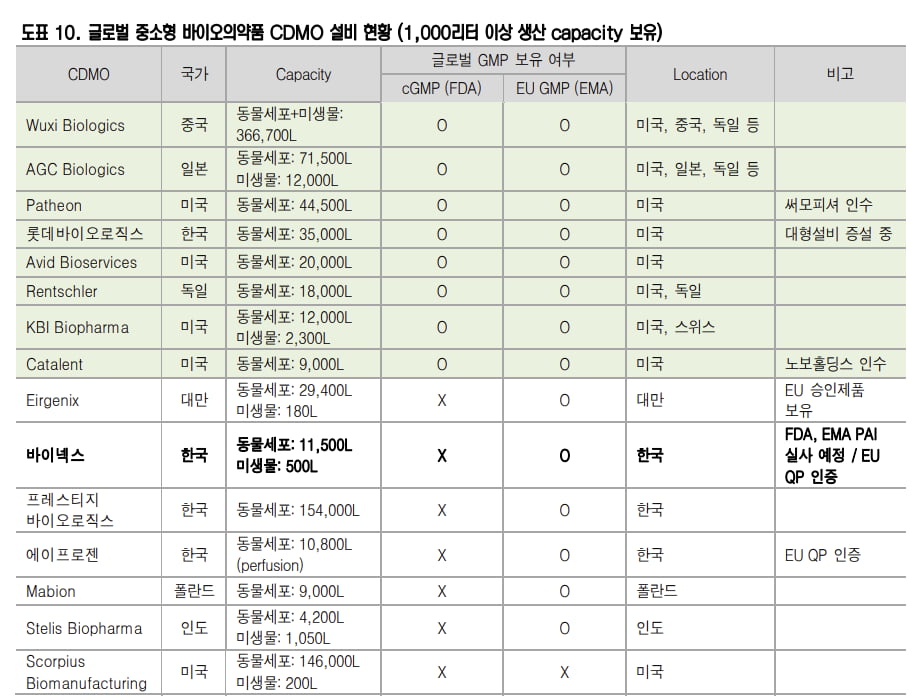
日 AGC, KBI, 美 에비드, 獨 렌슬러 등 당장 교체 가능한 곳 4곳뿐
안타깝게도 당장 우시그룹의 물량을 바로 소화할 수 있는 기업엔 한국기업은 없다. 정 연구위원은 “우시바이오로직스의 이전 물량을 당장 소화할 기업은 전 세계에서 일본 AGC바이오로직스·KBI바이오파마, 미국 에비드바이오서비스, 독일 렌슬러 등 4곳에 불과하다”고 말했다.바이오의약품의 경우 강화되고 있는 미국 식품의약국(FDA)과 유럽 의약품청(EMA)의 CMC 기준을 모두 충족해야 우시 등의 기존 일감을 가져올 수 있다. 정유경 연구위원에 따르면 현재 미국 우수 의약품 품질 관리 기준(cGMP) 인증과 유럽 인증을 모두 받은 중소형 CDMO업체는 전 세계 총 8곳에 불과하다. 이 가운데 우시를 제외하고, 인수합병(M&A) 등으로 CDMO로서의 독립성이 부족한 파테온(미국 써모피셔가 인수), 카탈란트(덴마크 노보홀딩스가 인수), 대형 CDMO를 추구하는 롯데바이오로직스 등도 제외하면 4개 기업만 남게 된다.
정 연구위원은 "현재 셀트리온 바이오시밀러 제품 생산을 위한 FDA 실사를 받고 있기 때문에 조만간 FDA와 EMA의 기준을 모두 충족하는 글로벌 CDMO 반열에 오를 수 있다"고 강조했다. 또한 “40여건의 글로벌 허가기관의 실사 및 인증 경험을 보유하고 있으며 핵심 고객사인 셀트리온의 바이오시밀러 품목에 대한 FDA의 BLA(품목허가신청) 심사를 수검 중에 있어 승인 시 cGMP 인증 설비의 지위를 확보하게 된다”며 “연내 BLA 승인 시, 또는 6월 FDA 실사 이후 공유될 피드백만으로도 고품질의 중소형 CDMO 설비를 선점하고자 하는 글로벌 기업의 러브콜을 받을 수 있을 전망”이라고 했다.
中 우시 빈자리 노리는 韓 중소CDMO업체들
그는 바이넥스의 강점으로 ‘다양한 플랫폼’으로 유연한 서비스가 가능하다는 점을 꼽았다. 그는 “바이넥스의 설비는 가장 수요가 높은 동물세포 배양설비 4500L 4개 제조 스위트에 더해 미생물세포 배양설비 500L 1개 스위트, 완제의약품 필·피니시 설비 1개 스위트를 보유해 원제부터 완제까지 원스톱 생산을 제공할 수 있는 점이 장점”이라고 강조했다.또 “완제설비의 경우 액상 바이알, 동결건조 바이알, 프리필드 시린지(PFS)가 모두 가능해 고객의 다양한 제형 니즈를 충족시킬 수 있다”며 “또한 세포주 구축부터 공정개발, 분석법 개발까지 R&D 서비스를 제공해 위탁생산(CMO)에서 임상시험수탁(CRO)으로 서비스 영역을 넓히고 있다”라고도 했다.
그는 “고객이 타깃 물질만 가져오면 세포주 개발부터 상업물질 생산까지 전 과정을 수행해 줄 수 있는 점은 삼성바이오로직스, 스위스 론자와 같은 글로벌 CDMO 기업에서 확인할 수 있는 역량”이라며 “우시바이오로직스, 카탈란트가 사라진 중소형 CDMO에서 바이넥스가 두각을 나타낼 것으로 전망된다”고 밝혔다.
이밖에 시장에선 바이넥스 외 국내 세포·유전자치료제 CDMO 강자인 차바이오텍과 SK팜테코, 글로벌 3위 올리고핵산 치료제 CDMO업체인 에스티팜 등도 생물보안법의 수혜를 볼 것으로 기대하고 있다.
안대규 기자 powerzanic@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


