EGFR 변이 양성 비소세포폐암 환자들의 삶을 밝혀줄 3세대 EGFR TKI, 렉라자®
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
렉라자®의 특징과 작용 기전, 개발 과정 및 임상시험 결과
렉라자® 제품명에는 렉라자®의 높은 EGFR 돌연변이 선택적 항암 효과를 뜻하는 Selectivity의 ‘LEC’와 렉라자®의 성분명 Lazertinib(레이저티닙)의 ‘LAZ’가 결합했다.
종합해보면, 렉라자®가 변이가 일어난 비소세포폐암 환자의 EGFR에 선택적으로 결합해 강력한 항암 효과와 우수한 안전성을 나타냄을 의미한다.
로고는 렉라자®의 세포 내 활동을 상징하는 모양으로 디자인됐다.
새로운 치료제를 의미하는 청록색, 행복과 희망의 노란색, 치료제의 활력, 긍정적 영향 등 혁신을 의미하는 붉은색으로 색상마다 의미를 내포하고 있다.
폐암은 처음 진단 시 이미 상당히 진행된 상태인 경우가 많고 재발과 전이가 빈번해 사망률이 높은 암 질환이다.
폐암은 국내 암 사망 원인 1위로 인구 10만명당 2012년 33.1명이었으나 2022년 36.3명으로 크게 증가했다.
EGFR(Epidermal Growth Factor Receptor, 표피성장인자 수용체) 유전자 돌연변이는 티로신 키나아제 (tyrosine kinase) 영역(domain)에 발생하여 EGFR 키나아제의 활성을 증가시킨다.
이 키나아제가 암세포의 생존, 증식, 전이 등에 영향을 미치는 것이다.
렉라자®는 EGFR 돌연변이에 대한 선택성이 높아 강력한 항종양(anti-tumor) 효과 확인
렉라자®는 EGFR 변이 양성 비소세포폐암 환자 1차 치료, 2차 치료 모두 임상시험을 통해 대조군 대비 우수한 항종양 효과 확인
렉라자®는 뇌혈관장벽(BBB)을 통과해 기존 1-2세대 표적치료제의 미충족 수요였던 ‘뇌전이에 대해 우수한 항종양 효과’를 보임
렉라자®는 심독성과 관련된 QTc 연장, 좌심실 구출률 감소와 연관이 적음
렉라자®는 1차, 2차 치료 모두 양호한 안전성 프로파일을 보였음.
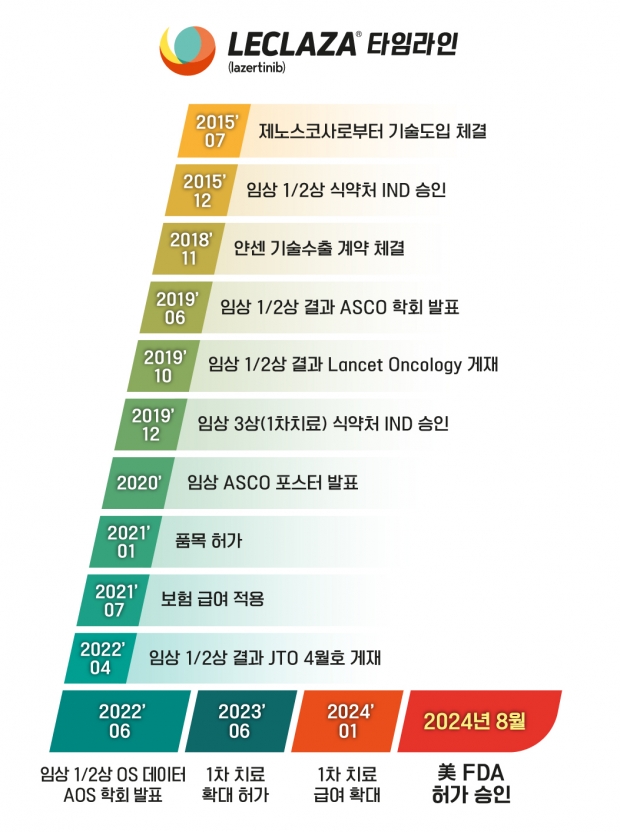
2015년 7월 유한양행은 제노스코사로부터 기술도입 계약을 체결했다.
이후 유한양행은 물질 최적화와 공정개발, 그리고 비임상 및 임상연구를 통해 렉라자®의 가치를 높였다.
2023년 6월 30일 렉라자®는 국내 식품의약품안전처로부터 EGFR 엑손 19 결손 또는 엑손 21(L858R) 치환 변이된 국소 진행성 또는 전이성 비소세포폐암 환자의 1차 치료로 확대 허가됐다.
유한양행은 2023년 6월 30일 렉라자®의 EGFR 변이 양성 비소세포폐암 환자의 1차 치료로 확대 허가 받고 난 후 이어 7월 조기 공급 프로그램(Early Access Program, EAP)을 실시했다.
