바이오니아, SRN-001 비만 치료용 조성물로 한국·러시아 이어 일본서 특허 등록 결정
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
항섬유화증 임상 1상 종료 후 임상 2상 단계에서 비만 치료제까지 적응증 확장 계획 전임상 비만 마우스 모델 동물실험에서 대조군 대비 내장 지방률 약 70% 감소
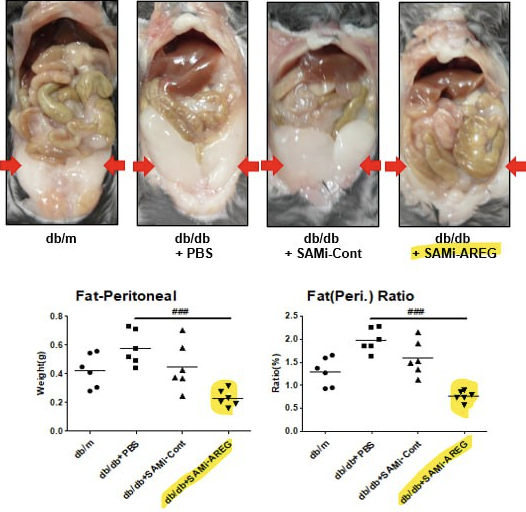
이번 특허 등록으로 SRN-001은 Amphiregulin(이하 AREG)을 타겟으로 하는 동급 최초(First-In-Class) 비만 예방 및 치료제로서 일본에서 특허권을 확보하게 되었으며, 비만조절약물(Disease Modifying obesity drug)로 임상개발 투자의 확고한 기반을 마련하게 되었다. 현재 한국(10-2671315), 러시아(2810514)에서 특허 등록이 완료된 상태이며, 일본에서 특허 등록이 결정되었다. 이어 미국, 유럽, 중국, 인도, 브라질, 호주, 캐나다 등 주요 국가에서 특허 심사가 진행 중이다.
써나젠 연구진은 비만 및 당뇨 마우스 모델 전임상 연구에서 SRN-001의 항비만 효과를 확인한 바 있으며, 이를 바탕으로 비만 예방 및 치료제로서의 적응증 확대를 목표로 모회사 바이오니아와 공동으로 특허 출원을 진행해왔다. 이번 일본에서 등록된 특허는 SRN-001이 GLP-1과 달리 비만 세포의 증식을 억제하는 새로운 기전을 기반으로 비만 예방 및 치료용 조성물로서 인정받은 것이다.
SRN-001은 새로운 지방 생성 성장인자인 AREG를 타겟으로 하여, 비만 마우스 모델 동물 실험에서 AREG의 발현을 줄임으로써 지방세포의 증식과 분화를 억제하고, 대조군 대비 내장 지방률을 약 70% 감소시키는 효과(사진)를 보였으며, 이는 복부비만의 주요 원인인 지방세포 증식을 억제하는 새로운 기전을 보여준다. 또한 체중, 피하지방, 지방세포 면적을 감소시키고, 간에서 지방이 축적되는 지방간을 억제하는 효능도 추가적으로 확인되었다. 이는 내장지방으로 인한 합병증인 심혈관 질환, 대사 질환, 당뇨병 및 기타 다양한 질환의 치료 및 예방에 활용될 가능성을 보여준다.
바이오니아와 써나젠테라퓨틱스는 SRN-001의 비만 치료제로서의 잠재력을 추가 연구와 임상 단계를 통해 더욱 구체화할 계획이다. 현재 비만 치료제 시장은 GLP-1 기반 치료제가 주류를 이루고 있으며, 골드만 삭스는 이 시장이 2030년까지 1000억 달러 규모로 성장할 것으로 예상하고 있다. SRN-001은 GLP-1과는 다른 기전으로 세계 최초로 시도되는 물질로, 현재 진행 중인 항섬유화증 임상 1상이 완료된 후, 임상 2상 단계에서 비만 치료제까지 적응증을 확장하여 진행할 계획이다.
한편, 써나젠 연구팀은 건강인을 대상으로 호주에서 SRN-001 임상 1a상을 완료하였고, 지금까지 비임상 관련 총 7편의 논문을 발표하며 다양한 섬유화증의 치료제로서의 가능성을 모색해 왔다. SRN-001은 항섬유화증 치료 물질 특허로 미국 특허를 비롯한 주요국에서 특허가 등록된 상태다. SRN-001은 섬유화를 유발하는 섬유아세포로의 분화와 증식을 막는 물질로서, 바이오니아와 써나젠 연구팀은 동물 모델 연구로 브라운대학교 이춘근 교수 연구팀과 공동 연구로 폐섬유화증에 대한 연구 논문을 발표하였고, 순천향대학교 이은영 교수팀과의 공동 연구로 신장섬유화증 관련 연구 논문을 발표한 바 있다. AREG는 다양한 섬유화증과 암 조직에서 발현되어 질환 기전이 많은 논문에 보고되어 최근 주목받기 시작한 타겟으로, 20여 종의 섬유화증에 질환 조절 치료제(DMD)로서 효과를 보일 것으로 연구진은 기대하고 있다. 섬유화증은 아직 근본적인 치료제가 없어, 치료제 시장은 잠재적으로 1000억 달러 규모에 이를 것으로 예상된다.
바이오니아 박한오 회장은 “섬유화성 질환 치료제 시장은 1000억 달러 규모이고, 비만 예방 및 치료제 시장도 2030년 1000억 달러 시장이 예상된다. SRN-001이 섬유화증과 비만 질환의 근본 원인을 공략하는 동급 최초 약물 후보물질로 주요 선진국에서 특허를 확보했고, 총 2000억 달러 규모의 엄청난 시장 잠재력을 가지고 있다. 호주 임상 1a에서 유효 용량의 10배 투여에서도 독성이 발견되지 않아, 비임상 시험에서 확인된 바와 같이 FDA 허가된 siRNA 치료제 대비 탁월한 안전성을 확인한 만큼, 향후 진행될 임상에서 질환 조절의 유효성만 증명된다면, 초대형 블록버스터 약물로서 성공 가능성이 매우 높다고 볼 수 있다. 올해, 구조조정을 통한 조직 개편으로 임상 개발과 적응증 확대 연구에 집중하여, 초대형 블록버스터 신약으로 성공시키는 데 박차를 가하겠다”고 일본 특허 등록 결정의 소감을 밝혔다.
