메드팩토, 뼈질환 치료제 ‘MP2021’ 네이처 자매지 게재
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
– 관절염에서 파골세포 억제 및 염증 개선 확인, 유력 학술지 ‘본 리서치’ 게재
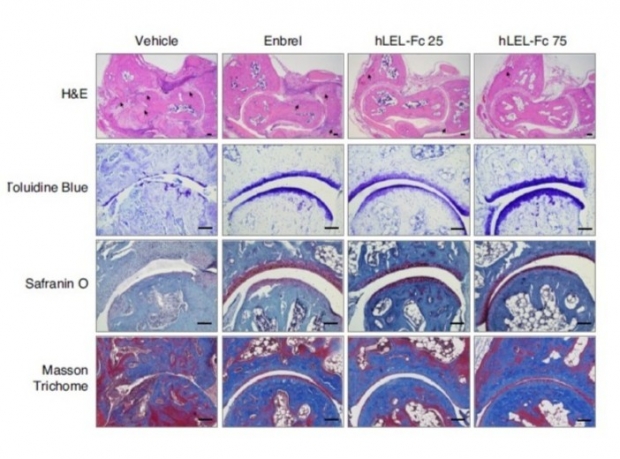

‘MP2021’은 파골세포 등에 작용하는 유전자 ‘TM4SF19’를 저해하는 물질이다. 골다공증, 골소실 질환, 암으로 인한 뼈 전이 등을 적응증으로 KDDF(국가신약개발사업단)의 지원을 받아 개발 중이며 연내 임상 승인을 목표로 하고 있다.
이번 연구에서 메드팩토는 재단법인 길로와 공동으로 콜라겐 유도 관절염(CIA, Collagen-Induced Arthritis) 동물 모델에 ‘MP2021’을 투약한 결과, ‘TM4SF19’ 저해로 인해 비정상적인 파골세포의 활성이 억제되고 염증 및 골 파괴가 유의미하게 개선된다는 것을 입증했다.
또한 ‘MP2021’에 의한 ‘TM4SF19’ 저해가 염증 및 골 파괴를 동반한 질환 진행을 억제하는 치료 효과와 예방 효과를 모두 갖추고 있음을 밝혀냈다고 덧붙였다.
이와 관련, 메드팩토 관계자는 “이번 연구에서 대조약으로 사용한 엔브렐 등 기존 치료제가 염증 개선에 치중하는 반면 ‘MP2021’은 소실된 뼈를 회복할 수 있는 것이 특징”이라며 “이번 연구에서 ‘TM4SF19’ 저해 전략이 염증성 뼈질환뿐 아니라 골다공증 등 퇴행성 뼈질환까지 포괄적으로 치료할 수 있는 가능성을 확인했다는 것이 중요한 성과”라고 밝혔다.
‘TM4SF19’는 류마티스 관절염, 골다공증 등의 원인이 되는 파골세포 다핵화 형성에 영향을 주는 신규 표적 단백질로, 김성진 메드팩토 대표가 세계 최초로 작용기전을 규명해 발표한 바 있다.
‘본 리서치’는 세계 최고 권위의 학술지 네이처(Nature)의 자매지로, 뼈 대사 및 뼈 질환 분야에서 가장 권위있는 학술지이다. 끝.
ADVERTISEMENT
ADVERTISEMENT



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


