
암 환자가 아닌 일반인의 몸에서도 세포분열 중 일어나는 돌연변이에 의해 암세포는 언제든 만들어진다. 그럼에도 암이 발생하지 않는 까닭은 우리 몸의 면역체계가 암세포를 제거하기 때문이다. 반대로 말하면 종양(암)이 성장할 수 있는 것은 우리 몸의 면역체계가 제대로 작동하지 않기 때문이다. 최근에는 암 주위에 형성되는 종양미세환경이 그 원인 중 하나로 지목되고 있다. 암세포를 제거하기 위해 T세포와 NK세포 등 강력한 면역세포가 접근하다가도 종양미세환경에서 무력화되기도 하기 때문이다.
유틸렉스의 후보물질 EU103은 종양미세환경을 만들고 T세포를 무력화시키는 종양 주변 대식세포(TAM)를 타깃으로 하는 항체치료제다. 종양미세환경에서 발현되는 TAM을 타깃으로 해 NK세포나 T세포가 종양을 제거할 수 있도록 하는 방식으로 작동한다.
종양 주변 대식세포를 중점 공략
EU103의 타깃은 TAM과 M2 대식세포(M2 macrophage)에서만 특이적으로 발현하는 면역관문 수용체인 ‘VSIG4’다. 이 단백질이 T세포 표면의 특정 수용체와 서로 결합하면 T세포가 불활성화된다. 항체치료제인 EU103이 VSIG4에 대신 결합해 T세포가 불활성화되는 것을 막는 식으로 작동하는 게 기본 작용기전이다. EU103의 연구개발을 담당하고 있는 유틸렉스의 항체치료팀 김혜정 책임연구원은 “VSIG4에 대한 EU103의 결합친화성이 T세포의 수용체보다 높아 더 경쟁적으로 붙는다”면서 “이미 T세포와 VSIG4가 붙은 경우에도 이를 떼어내고 결합할 정도”라고 설명했다.
VSIG4가 T세포 표면의 어떤 수용체와 결합하는지는 아직 명확하게 밝혀지지 않았다. 김 책임연구원은 “T세포에 있는 이 수용체의 정체를 명확하게 밝혀내는 게 남은 과제”라고 말했다.
TAM은 T세포를 억제하는 것 외에도 종양의 생존과 발달을 위해 다양한 역할을 한다. 신생혈관을 촉진하는 혈관내피세포성장인자(VEGF)와 종양의 성장을 돕는 표피성장인자(EGF) 등을 분비해 종양미세환경의 구축을 촉진한다.
EU103은 TAM을 M1 대식세포로 표현형을 바꾸는 효과가 있다. M2 대식세포는 T세포를 억제하는 등 항염증 반응을 관장하는 반면 M1 대식세포는 면역계를 자극하는 역할을 한다. 대식세포의 표현형을 M2에서 M1으로 바꾸기 때문에 종양미세환경의 발달도 억제할 수 있다.
내년 임상 돌입
TAM에 발현하는 VSIG4 수용체를 타깃으로 하는 EU103의 기전은 비교적 ‘유니크’한 케이스로 꼽힌다. VSIG4와 결합하는 T세포의 짝(counterpart)이 아직 밝혀지지 않았다는 것도 이 점을 뒷받침해준다. 권병세 유틸렉스 대표는 “이전에 대형 제약사에서 대식세포를 타깃으로 한 시도를 했다가 종양미세환경에 있는 대식세포 외에도 일반 대식세포까지 죽으면서 전신에서 부작용이 나와 실패한 사례가 있다”며 “유틸렉스는 전체 대식세포 중 M2 대식세포와 TAM만 노리도록 해 부작용을 크게 줄였다”고 말했다.
EU103의 또 다른 장점은 혈액암을 제외한 모든 고형암에 적용할 수 있다는 점이다. 어느 위치에 발생한 암이든 TAM이 발현되기 때문이다. 권 대표는 “특히 난소암에서 VSIG4의 발현이 왕성한 것으로 알려져 난소암에서 좋은 효과가 나올 것으로 기대하고 있다”고 설명했다.
EU103은 올해 안 비임상을 마치고 내년에 임상에 착수할 계획이다. 전임상시험에 참여하고 있는 김 책임연구원은 “EU103 자체가 인간을 타깃으로 한 항체이기 때문에 실험용 쥐에선 실험이 사실상 어려워 면역체계를 인간화한 쥐에서 실험을 진행하고 있다”며 “최근 PD1 계열 면역관문억제제와 병용 투여했을 때 원하던 결과를 얻고 있어 내부적으로 기대감이 커지고 있다”고 말했다.
유틸렉스가 개발 중인 또 다른 후보물질인 EU101은 키트루다와 병용하는 동물실험에서 좋은 결과를 얻으면서 임상시험을 진행하는 데 탄력이 붙었다. 지난 12월 유틸렉스는 4-1BB 단클론항체 EU101의 글로벌 다국가 임상 1·2상 임상시험계획(IND) 신청을 마쳤다. 면역세포의 ‘브레이크’를 담당하는 면역관문을 억제하는 방식으로 작동하는 면역관문억제제와 달리 EU101은 면역세포의 ‘가속페달’을 밟는 식으로 작동하는 면역관문활성제다. EU101에 의해 자극받은 4-1BB 신호는 면역계 T세포를 활성화하고 증식시켜 최종적으로 암세포 공격을 유도한다.
특히 인간 면역이 이식된 인간화 생쥐에서 인간 항체를 바탕으로 진행한 동물실험의 데이터를 주목해볼 만하다. 200㎣ 크기 종양에 키트루다와 EU101을 각각 투여했을 때 EU101의 항암 결과가 더 우수했다.
키트루다는 10㎎/㎏ 투여군에서는 항암 효과를 냈으나 5㎎/㎏ 투여군에서는 암 발생을 늦추는 효과에 그쳤다. 반면, EU101은 5㎎/㎏ 투여군에서 항암 효과를 보였고, 10㎎/㎏ 투여군에선 거의 완전하게 종양을 제거했다. 면역관문활성제는 아직 시장에 나온 제품이 없어 대표적 ‘블루오션’으로 꼽힌다. 권 대표는 “EU101은 다른 기업의 면역관문활성제와 구분되는 항원 결정기(epitope)를 갖고 있어 간독성이 낮고 구조적으로도 더 안정적”이라고 설명했다.
유틸렉스는 2017년 중국에 EU101의 중국 전 지역 대상 개발권 및 판권을 기술 수출했다. 계약금 100만 달러, 10개 적응증 승인 시 최대 3550만 달러 규모 기술수출이었다. 지난해 9월 중국 식약처 IND 승인을 받으며 두 번째 마일스톤을 확보한 상태다. EU101의 중국 임상 1상 첫 환자 투약이 올해 초 진행될 것으로 예상된다.
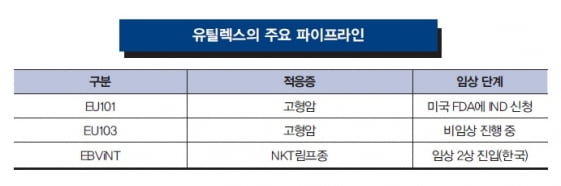
유틸렉스는 지난달 4-1BB 단클론항체 EU101의 글로벌 다국가 임상시험 1·2상 허가를 신청했다. 임상 승인이 나면 진행성 고형암 환자를 대상으로 EU101을 투약해 안전성과 유효성, 양독학 등을 평가할 계획이다. 4-1BB는 대표적인 면역관문활성제로 MSD, 화이자 등 글로벌 제약사들도 관심이 있는 후보물질로 성과가 기대된다.
이우상 기자 idol@hankyung.com









