수젠텍, 현장진단용 코로나19 신속 항체진단키트 美 FDA 승인
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
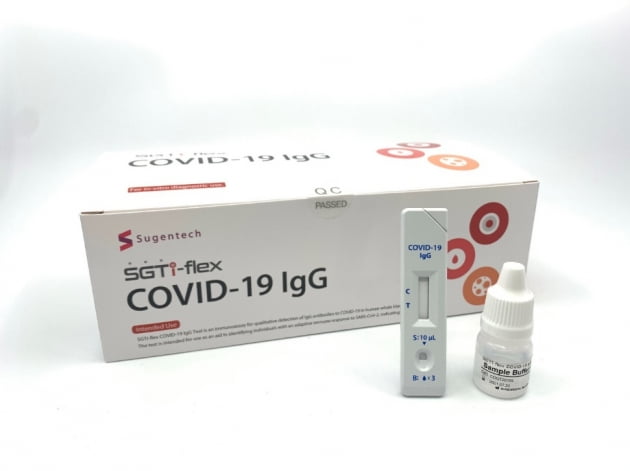
이 진단키트는 미국실험실표준인증(CLIA) 면제가 적용됐다. CLIA 면제 제품은 실험시설이 있는 대형병원에서만 쓰이는 기존 제품과 달리 소형병원과 약국에서도 개인을 대상으로 판매 가능하다. 국내 기업 중 CLIA 면제를 조건으로 미국에서 EUA를 획득한 코로나19 항체진단키트를 내놓은 기업은 수젠텍이 유일하다. 세계에선 다섯 번째다.
수젠텍의 신속 항체진단키트는 손끝에서 채취한 혈액을 이용해 코로나19 항체의 일종인 ‘IgG’ 항체의 생성 여부를 10분 안에 확인하는 제품이다. 이 회사는 지난해 9월 이미 항체진단키트로는 국내 기업 최초로 미국 FDA에서 EUA를 획득한 바 있다. 당시엔 손끝에서 채취한 혈액이 아닌 정맥혈을 이용한 항체 검사 방법으로 EUA를 획득해 대형병원이나 검진센터에서만 사용할 수 있었다. 수젠텍은 이번 EUA 획득으로 대형병원부터 소형병원, 약국까지 아우르는 유통망에 항체진단키트 판매가 가능하게 됐다.
수젠텍은 미국 FDA 승인을 인정하는 다른 국가에도 해당 진단키트를 판매할 계획이다. 이 회사는 항원진단키트로도 미국 FDA의 EUA 획득 절차를 진행 중이다. 유럽 CE 인증을 획득해 독일, 브라질, 러시아, 오스트리아 등에 이미 공급하고 있다.
수젠텍 관계자는 “항체검사는 각 나라 보건정책에 따라 백신 접종 후 면역 형성, 무증상 감염 확인, 감염 이력 확인 등을 즉각 판단하는 등 폭넓은 적용이 가능하다”며 “약국으로도 판매채널을 확대할 경우 수요가 상당해 매출 기여가 클 것으로 기대한다”고 말했다.
이주현 기자 deep@hankyung.com