동반진단은 의약품 사용 시 안전하고 효과적으로 사용할 수 있도록 대상자를 선정, 치료 반응을 모니터링하여 잠재적 심각한 부작용이나 위험을 예측하는 검사다.
동반진단을 목적으로 하는 체외진단 의료기기(IVD CDx·In vitro Companion Diagnostic Devices)는 여러 목적으로 사용될 수 있다. 미국 식품의약국(FDA)의 가이드라인에 따르면 특정 의약품에 효과적인 환자 집단의 선별, 특정 의약품 치료 또는 처치에 따른 심각한 이상반응의 위험성을 초래할 것 같은 환자 집단을 확인, 특정 의약품에 대한 안전성 혹은 효능을 개선할 목적으로 반응성을 모니터링하는 데 사용될 수 있다.
동반진단 시장 동향
의료 환경과 치료의 패러다임이 질병 중심에서 환자 중심으로 변화하면서, 환자 중심의 의료서비스를 통해 큰 가치가 창출된다고 여겨지고 있다. 질병 중심 모델은 증거 기반의 단기적인 환자의 치료에만 목적을 두는 반면, 환자 중심 모델에서는 장기적인 관점에서 질병의 예측 및 예방이라는 소비자 중심의 의료서비스를 최우선으로 한다.
보건의료 패러다임은 지속적인 환자 건강 증진, 환자 맞춤형 진단 및 치료 등으로 가치창출의 영역을 확대해감에 따라 맞춤의료(personalized medicine) 분야는 더욱 부각될 것으로 전망된다.
이러한 맞춤의료에 부합하는 의료서비스의 한 예가 동반진단이다. 1970년대 유방암 치료제와 타깃(에스트로겐 수용체)의 상태가 치료 효과와 상관성이 있다고 알려진 이래로 동반진단 제품의 개발은 꾸준히 증가되어 왔다.
최근에는 합성의약품의 신약 개발이 둔화되고, 질병치료 패러다임이 화학요법에서 표적치료제 및 면역치료제 등의 바이오의약품을 이용한 맞춤의료로 변모하면서 동반진단 시장이 주목받고 있다. 이러한 동반진단은 해당 치료제를 적용할 환자를 선별하거나 약물 반응을 예측하기 위해 혹은 환자 개인 맞춤 치료를 위한 반응성 모니터링을 위해 사용하게 된다.
바이오의약품 시장은 급속도로 성장하는 추세로 전체 의약품 시장에서의 매출 비중은 2026년 35%로 증가할 것으로 전망되고 있다. 이런 추세는 1세대 바이오의약품의 특허가 만료되거나, 만료시점이 가까워지면서 바이오시밀러 제품의 시장 진입 본격화와 동시에 고령화로 인한 의료비 지출 증가에 기인한다. 특히 항체치료제는 바이오의약품 중 21.1%의 비중을 차지하고 있다.
항체치료제 시장의 성장세와 더불어 글로벌 매출 2위(2020년 기준)인 얀센의 오리지널 항체치료제인 레미케이드의 인플릭시맙 제제의 약동력학(PK) 및 항체 생성(ADA)의 면역원성 모니터링(TDM)이 약물 효능 증대와 부작용 감소뿐만 아니라 의료비 절감효과를 기대할 수 있는 맞춤의료 관점에서 대두되고 있다.
인플릭시맙 제제의 PK 및 ADA 모니터링 검사는 항체치료제 투여 직전에 측정하고 투여 결정을 할 수 있어야 한다. 그러나 상용 검사제품의 대부분이 ELISA 제품으로 구성되어 있어서 환자의 혈액을 채취 후 검사결과를 통해 치료제의 다음 투여 결정에 반영하기까지 상당한 기간(2~3주)이 소요됨에 따라 그 검사결과는 투여 직전의 환자 상태를 반영하기 어려운 제한점을 가지고 있다.
따라서 다음 투여 직전에 PK 및 ADA 검사 결과를 즉시 반영할 수 있는 현장검사에 대한 관심이 증가하고 있는 추세다.
효능
바디텍메드는 오랜 기간 면역진단 제품 개발의 기술력을 바탕으로 치료제의 혈중 PK와 ADA를 모니터링할 수 있는 현장검사용 자동화 검사가 가능한 제품을 개발하는 데 성공해 ‘AFIAS Infliximab’과 ‘AFIAS Total Anti-Infliximab’ 2종 제품을 2020년 말에 출시하였다. 올해 4월에는 셀트리온헬스케어에 램시마 처방에 따른 동반진단 제품으로 공급계약을 체결했다.
바디텍메드의 AFIAS Infliximab 제품은 인플릭시맙의 PK를 모니터링하는 제품으로 현장검사용 자동화 검사제품으로 개발됐다. 10분 이내에 검사가 완료되며, 모든 혈액 타입
(전혈·혈장·혈청)이 사용 가능하다는 장점을 가지고 있다.
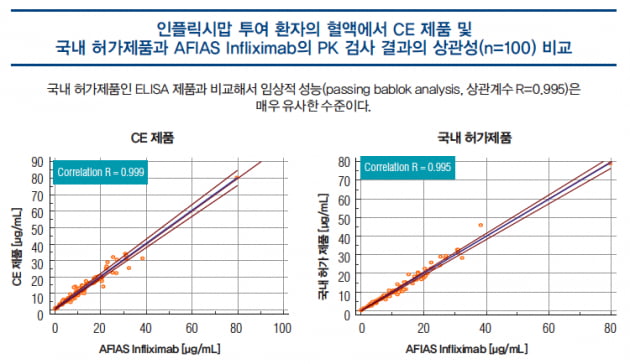
이는 국내 허가제품인 ELISA 제품과 비교해서 임상적 성능(passing bablok analysis, 상관계수 R=0.995)은 매우 유사한 수준이다<66쪽 그래프>. 반면 반응시간, 가용 혈액 타입, 자동화 검사 등에서는 사용자의 편의성이 상당히 향상된 제품이다. 특히 짧은 검사시간으로 치료제 투여 직전에 투여 결정을 할 수 있어서 맞춤의료에 매우 적합한 제품으로 평가된다.
한편, 바디텍메드의 AFIAS Total Anti-Infliximab 제품은 인플릭시맙의 ADA를 모니터링하는 제품으로 현장검사용 자동화 검사제품으로 개발되었다.
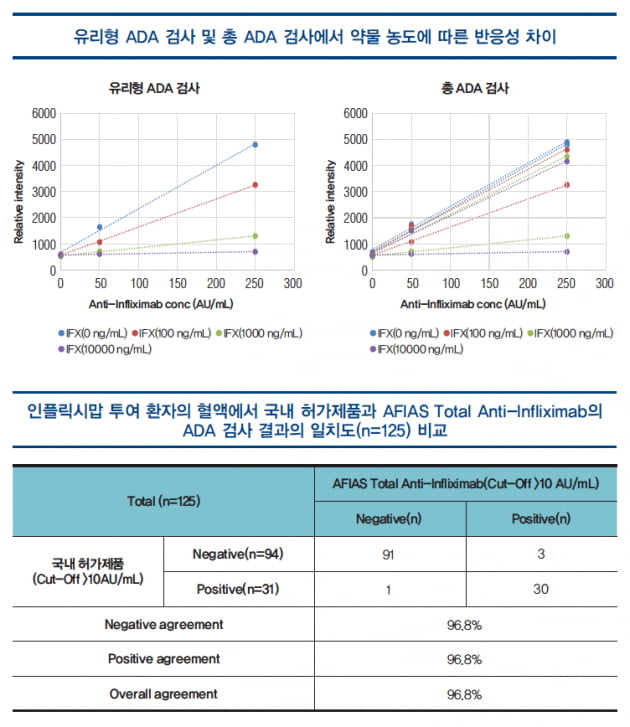
국내뿐만 아니라 해외에서 판매되는 대부분의 제품은 유리형의 ADA 제품으로써 혈중 인플릭시맙과 결합하고 있는 ADA는 검사가 불가능하다. 이는 약물 내성(drug tolerance) 효과에 기인한 것으로 ADA 검사에서 혈중 약물의 농도에 따라 ADA 검출이 제한되는 것을 의미한다.
반면, 바디텍메드에서 개발한 제품은 투여한 인플릭시맙과 결합한 ADA도 검사가 가능하도록 개발되어 있어 혈중 약물 농도에 영향이 거의 없이 ADA 검출이 가능하여 유리형 검사보다 그 임상적 유효성은 크다고 할 수 있다.
AFIAS Total Anti-Infliximab 제품은 22분 이내에 검사가 완료되며, 국내 허가제품인 ELISA 제품 1종과 비교해서 임상적 성능(agreement, 총 일치도 97%)은 유사한 수준이다<67쪽 표>. 반면 상대적으로 매우 짧은 반응시간 및 자동화된 검사방법을 통해 사용자 편의성이 극대화되었으며, 환자 맞춤 치료를 위한 모니터링 제품으로 매우 적합한 제품이다.
향후 계획
항체치료제의 PK, ADA 모니터링 시장은 주로 ELISA 기반의 진단기기가 대세를 이루고 있다. 환자는 치료제 투여 시마다 병원에 방문해야 하며, 필요한 경우 치료 유지효과를 확인하기 위해 PK, ADA 검사를 하게 된다. 이때 치료제 투여 전 추가 방문을 통해 ELISA 검사를 하는 번거로움이 있다. 따라서 이러한 진단시장에서 점차적으로 POC의 니즈가 증가하고 있는 추세이나, 아직까지 대표선수가 없다고 해도 과언이 아니다.
따라서 바디텍메드는 류머티즘 질환 및 염증성 장질환 치료제인 인플릭시맙의 PK, ADA 모니터링 제품을 기반으로 한 시장 진입을 계기로 시장 선점 및 우위를 지속하기 위한 파이프라인 확대를 활발히 진행하고 있다. 향후 1년 내에 항암치료제 및 자가면역치료제 8종에 대한 PK 및 ADA 제품 출시를 계획하고 있다.
*이 기사는 <한경바이오인사이트> 매거진 2021년 6월호에 실렸습니다.