자가 CAR-T가 항암 치료에 실패하는 까닭
CAR-T를 이용해 치료에 실패하는 경우는 다양하다. CAR-T의 제조에 실패할 수 있고, 제조한 CAR-T를 주입했는데 완전관해에 실패하는 경우도 있고(1차 내성), 완전관해를 이루더라도 다시 재발하는 경우도 있다.
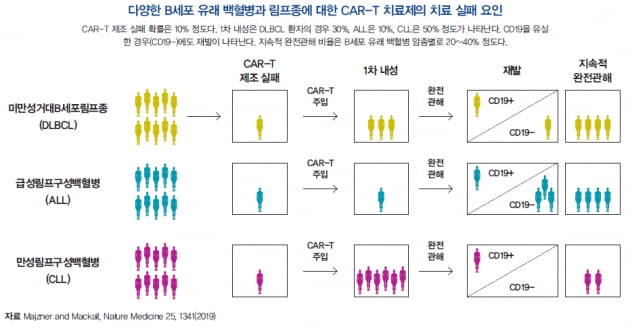
각 단계에서의 치료 실패율은 암종별로 차이가 있다. 제조 실패는 대략 10% 이내이며, 1차 내성은 만성림프구성백혈병에서 가장 높게 나타난다. 재발 시 표적으로 한 CD19를 유실한 암세포가 재발의 원인인 경우가 상당수이지만(CD19-), 그 외의 경우(CD19+)도 꽤 있다.
완전관해를 이룬 환자가 재발하는 경우는 암세포 중 일부가 CAR-T의 공격을 회피하거나 무력화할 수 있는 유전자 변이에 성공한 경우다. 이 중 다수는 암세포가 CAR-T의 표적인 CD19를 유실한 경우이며, 이를 극복하기 위하여 CD20, CD22 등 다중 항원을 표적하는 CAR-T 개발이 진행 중이다.
1차 내성의 경우 암세포 고유의 문제로 인한 경우도 있지만 환자의 T세포 상태가 좋지 않은 경우도 있다. 특히 만성림프구성백혈병의 경우는 환자의 T세포가 지속적인 항암치료에 노출되고 암세포에 교란돼 이를 이용하여 제조한 CAR-T가 환자의 체내에서 제대로 증식하고 암세포를 죽이지 못하는 경우가 많았다. 그래서 만성림프구성백혈병은 가장 먼저 CAR-T 임상 성공 사례가 보고된 질병이 면서 아직 승인받은 CAR-T치료제가 없는 질병이기도 하다.
이와 같이 환자의 T세포 상태가 좋지 않아 1차 내성이 나온 경우와 CAR-T의 제조 자체에 실패하는 경우, 혹은 3주 정도 걸리는 CAR-T의 제조기간 동안 환자의 상태가 급격히 나빠지는 경우(특히 급성림프구성백혈구의 경우) 등은 CAR-T 치료제가 환자 자신의 T세포(자가 CAR-T)를 이용해 제조하기 때문에 발생하는 문제다.
만약 공여자의 세포로 미리 품질이 보증된 CAR-T(off-the-shelf, 동종 CAR-T)를 제조해 동결보존하다 바로 사용할 수 있다면 치료 효능을 향상시킬 수 있을 것이다.
자가 CAR-T 치료제와 동종 CAR-T 치료제의 장단점을 정리하면 아래 표와 같다.
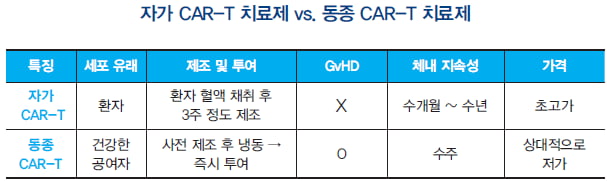
자가 CAR-T가 가진 한계점을 극복하기 위한 대안으로 동종 CAR-T 치료제 개발 열기가 뜨겁다.
동종 CAR-T를 이식하기 위해 반드시 해야 하는 것은 GvHD의 원인이 되는 T세포 수용체(TCR) 제거다. 알파와 베타 사슬로 이루어진 TCR 중 알파 사슬인 TRAC을 주로 제거한다. 원하는 유전자를 선별적으로 편집하는 데엔 유전자 가위 기술이 필요하다.
현재 임상에서 앞선 회사들은 주로 2세대 유전자 가위 기술인 탈렌(TALEN) 기반 기술을 사용하고 있으며, 후발주자들은 2010년대 중반부터 본격적으로 개발된 3세대 유전자 가위 기술인 크리스퍼(CRISPR/Cas) 기술을 사용하고 있다.
동종 CAR-T 치료제 임상에서 가장 두각을 보이고 있는 프랑스 제약사 셀렉티스 관련 기술과 임상 결과를 먼저 분석하고 이를 기반으로 동종 CAR-T 치료제의 특징 및 개선 방향에 대해 서술할 것이다.
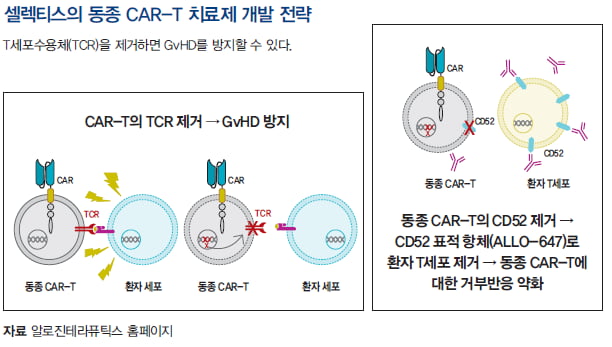
전자는 부작용을 줄이기 위해 필요한 것이고, 후자는 CAR-T의 체내 지속성을 증가시켜 효능을 올리기 위한 전략이다.
현재 셀렉티스가 개발한 동종 CAR-T 치료제 상당수는 미국에서는 알로진테라퓨틱스가, 미국 외 지역에서는 세르비에가 판권을 가지는 조건으로 임상 진행 중이다.
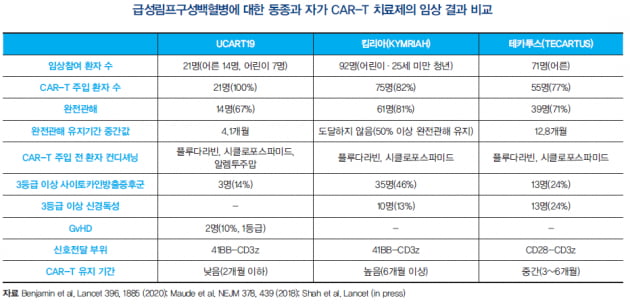
이 중 세르비에 주도로 급성림프구성백혈병의 임상을 진행 중인 ‘UCART19’의 임상 1상 중간 결과(2020년 랜싯 발표)를 자가 CAR-T 임상 결과와 비교분석해봤다
비교 대상은 노바티스의 킴리아 임상 2상 결과(2018년 NEJM 발표)와 길리아트-카이트 테카투스 임상 2상 결과(2021년 랜싯 발표)다.
우선 킴리아나 테카투스에서 제조 실패나 제조 기간 중 병세의 악화 등으로 임상에 참여했으나 CAR-T 치료제를 주입받지 못한 환자의 비율이 2~30% 정도임을 볼 때 모든 환자에게 미리 준비된 CAR-T 치료제를 주입할 수 있는 것은 동종 CAR-T의 큰 장점으로 보인다.
동종 CAR-T를 이용했을 때 가장 우려했던 GvHD를 포함한 부작용도 경미한 수준이다. 단기 효능 측면에서 완전관해 비율도 주목할 만했다. 하지만 완전관해가 유지되는 기간은 4.1개월로 킴리아나 테카투스에 비해 상당히 낮다는 점이 한계점으로 드러났다(킴리아가 완전관해 유지기간이 가장 긴 이유는 소아· 청년을 대상으로 해서 가능한 부분도 있다).
그 원인은 동종 CAR-T가 환자 T세포의 공격으로 체내 유지 기간이 짧아졌기 때문일 가능성이 크다. 일반적으로 CAR-T 치료 전 환자의 T세포를 플루다라빈·시클로포스파미드 등 독성이 강한 약을 사용해 제거해주며, 이러한 환자의 컨디셔닝은 주입한 CAR-T의 증식 및 생착을 통한 효능 증대에 중요한 역할을 한다.
동종 CAR-T 치료제의 경우 자가 CAR-T 치료제보다 한층 더 강한 환자 컨디셔닝이 필요하다. UCART19의 경우, 환자에게 CD52에 대한 항체(ALLO-647·알렘투주맙 등)를 처리해 추가적으로 환자의 T세포를 제거하는데, 이러한 추가 작업이 없을 경우 주입한 CAR-T가 환자의 체내에서 증식을 못해 치료 효능이 없어진다.
가혹한 환자의 컨디셔닝이 필수적이라는 점은 동종 CAR-T 치료제를 1회 이상 주입해 치료 효능을 향상하는 데 장벽으로 작용할 수 있다.
알로진테라퓨틱스는 예스카타를 성공적으로 개발한 카이트 출신 경영진이 설립한 회사다. 2018년 셀렉티스의 기술을 도입해 현재 림프 종(ALLO-501)과 다발성 골수종(ALLO-715) 등에 대한 임상을 활발하게 진행 중이다.
2021년 미국임상종양학회(ASCO)에서 ALLO-501을 이용한 임상시험(ALPHA)의 중간 결과와 ALLO-501A(약간 변형한 ALLO- 501)를 이용한 임상시험(ALPHA2) 중간 결과를 발표해 주목을 받았다.
ALPHA 연구에는 참여한 42명의 환자 중 41명이 CAR-T 치료제를 주입 받았다(평균 대기시간 5일). 41명의 환자 중 9명은 이전에 자가유래 CAR-T 치료제를 사용했던 사람이고, 32명의 CAR-T 치료제를 처음 주입한 환자 중 75%의 객관적 반응률(ORR·24명)과 50%의 완전관해률(CR·16명)을 보여줬다.
이는 자가 CAR-T 치료제와 비교해 손색이 없는 단기 치료 효능이다. 단, 완전관해의 유지기간은 아직 임상시험을 시작한 지 얼마 지나지 않아 명확하지 않다. 이 부분을 주목해서 봐야 할 것이다.
동종 CAR-T 치료제에서 CAR-T의 체내 지속기간이 짧아 완전관해의 유지기간이 짧은 부분을 보완하기 위해 2회 주입을 위한 임상 시험이 ALPHA2에는 포함돼 있다. 이 경우 1회 주입에 플루다라빈·시클로포스파미드·ALLO-647로 환자의 T세포를 제거하고, 2회 주입에서는 ALLO-647만을 사용해 환자의 T세포를 제거한다. 이 방법이 유효해 완전관해 유지기간 연장이 가능할지 궁금하다.
지금까지 셀렉티스가 개발한 동종 CAR-T 치료제의 임상 성과를 살펴봤다. 요약하면, 부작용은 낮고 초기 효능은 좋지만 효능이 지속되지 않는 한계점을 보였다. 그렇지만 ‘기성품(off-the-shelf)’ 치료제로서 가질 수 있는 큰 장점인 ‘다양한 유전자 조작을 통한 기능 강화’ 부분이 충분히 활용되지 않은 상황이므로 동종 CAR-T의 한계를 논하기에는 이르다고 생각한다.
현재 3세대 유전자 가위인 CRISPR-Cas를 이용한 다양한 동종 CAR-T 치료제 개발이 진행 중이다. ‘기성품’의 또 다른 장점은 냉동 보관하고 있는 세포치료제를 필요할 경우 여러 번 투여할 수 있다는 것이다.
안타깝게도 동종 CAR-T는 환자의 T세포를 최대한 제거해야 효능이 좋아지는데, 이 과정의 부작용이 심해 이런 기성품의 장점을 살리기에는 한계가 있을 가능성이 크다.
다음 글에서는 이 문제에서 조금 더 자유로워 기성품의 장점을 극대화할 수 있을 것으로 기대되는 자연살해(NK) 세포치료제에 대해 이야기할 것이다.
<저자 소개>

면역학을 공부하는 공학자다. 2006년 MIT에서 화학공학·고분자공학으로 박사학위를 받고 UCSF 의대에서 박사후연구원으로 근무했다. 이후 포스텍 시스템생명공학부·기계공학과 교수로 부임해 11년간 근무했고, 2019년 3월부터 서울대학교 재료공학부에서 생체재료를 면역치료에 적용하는 연구를 진행 중이다. <면역항암제를 이해하려면 알아야 할 최소한의 것들>이라는 대중서를 집필했다.
*이 글은 <한경바이오인사이트> 매거진 2021년 8월호에 실렸습니다.