"황반변성 바이오시밀러 시장 잡아라"
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
아일리아 복제약 개발 붐
오리지널 제약사 특허망 피해
먼저 상업화하는 업체가 유리
국내 기업 3곳 내년 임상 3상
오리지널 제약사 특허망 피해
먼저 상업화하는 업체가 유리
국내 기업 3곳 내년 임상 3상
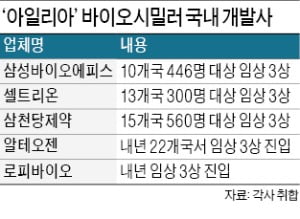
성장성을 본 글로벌 제약·바이오 업체 10곳 이상이 황반변성 치료제 아일리아(성분명 애플리버셉트) 바이오시밀러(바이오의약품 복제약) 개발 경쟁을 벌이고 있다. 세계에서 가장 많이 팔리는 자가면역질환 치료제 휴미라(아달리무맙) 못지않은 인기라는 평가다. 독일 바이엘과 미국 리제네론이 공동 개발한 아일리아는 작년 세계에서 11번째로 많은 약 8조원어치가 팔렸다.
황반변성은 비정상적으로 많이 생긴 신생 혈관이 황반을 손상시키면서 발생한다. 아일리아는 신생 혈관 생성을 부추기는 혈관내피성장인자(VEGF)와 태반성장인자(PLGF)를 억제한다. VEGF만 저해하는 경쟁 약물인 로슈의 루센티스(라니비주맙)와 다른 점이다. 개발을 마친 삼성바이오에피스와 종근당 정도를 제외하면 루센티스 바이오시밀러에 관심이 많지 않다. 글로벌 시장 규모가 아일리아의 절반(약 4조원) 수준이고 특허도 미국은 작년, 유럽은 내년 끝나는 등 상업화가 임박했기 때문으로 풀이된다.
아일리아는 국내에서만 다섯 곳이 개발하고 있다. 삼성바이오에피스와 셀트리온, 삼천당제약은 글로벌 임상 3상 중이다. 진도는 삼성바이오에피스가 앞서 있다. 10개국에서 446명을 대상으로 임상 중인데 내년 3월이면 끝난다. 셀트리온은 13개국에서 300명 규모로 진행하고 있다. 내년 하반기 임상이 마무리된다. 삼천당제약도 내년 3분기 종료를 목표로 15개국에서 560명을 대상으로 임상 중이다.
알테오젠은 오리지널과 다른 첨가제(안정제)를 넣는 독자 제형으로 아일리아 바이오시밀러를 개발 중이다. 임상 1상을 마쳤으며 2024년 출시가 목표다. 신생 바이오벤처 로피바이오는 내년 임상 3상에 들어가 2024년께 종료를 목표로 하고 있다. 지난달 대만 제약사에 중국과 대만, 동남아시아 지역 판권을 넘기며 성공 가능성을 보였다.
글로벌 제약사들도 눈독 들이기는 마찬가지다. 가장 앞선 곳은 비아트리스(옛 마일란)다. 최근 임상 3상 종료와 품목허가 신청을 공식화했다. 현재로서는 아일리아 바이오시밀러 상용화에 가장 앞선 것으로 평가된다. 암젠도 임상 3상 중이지만 결과는 내년 나온다. 이 밖에 포미콘, 산도즈, 코헤러스 등 글로벌 바이오 기업들도 경쟁 대열에 있다.
너도나도 아일리아 바이오시밀러 개발에 뛰어드는 것은 성장성 때문이다. 글로벌데이터에 따르면 2028년 습성 연령 유관 황반변성(wAMD) 시장 규모는 187억달러로, 2018년보다 두 배 성장할 것으로 전망된다.
관건은 오리지널 개발사들이 걸어놓은 거미줄 특허망을 피해 누가 가장 먼저 상업화에 성공하느냐다. 아일리아 오리지널 개발사는 미국(2023년 11월)과 유럽(2025년 5월)에 물질특허 외에 생산(2026년), 제형(2027년), 투여요법(2032년) 등에 대한 특허까지 걸어놨다. 바이오시밀러의 시장 진입을 최대한 늦추기 위한 전략이다. 유럽에서도 제형 특허가 2027년까지 걸려 있다.
한재영 기자 jyhan@hankyung.com



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


