유방암 치료제 '엔허투' 허가…국내 개발은 어디까지?
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
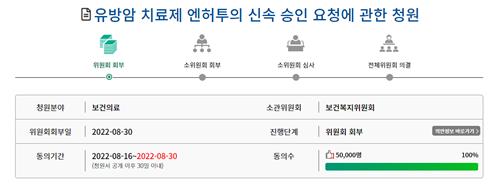
엔허투는 지난달 국민청원 홈페이지에서 5만 명의 동의를 얻은 청원의 주인공이다.
청원인은 "내성으로 다른 선택지가 없는 환자들을 위해 정식 도입이 신속하게 이루어질 수 있도록 속도를 내 달라"고 식약처에 요청했다.
24일 제약·바이오 업계에 따르면 셀트리온, GC셀 등 국내 업체들은 엔허투의 치료 범위인 HER2(사람 상피세포 증식인자 수용체 2형) 발현 유방암, 위암에 대한 치료제 개발을 활발히 진행하고 있다.
GC셀과 GC녹십자홀딩스가 미국 샌디에이고에 설립한 법인인 아티바 바이오테라퓨틱스는 최근 미국 식품의약국(FDA)으로부터 HER2 발현 유방암, 위암을 대상으로 하는 치료제 'AB-201'의 임상 1상과 2상 시험을 승인받았다.
이 치료제는 암세포에 특별히 반응하는 키메라 항원 수용체(CAR)와 자연 살해(NK) 세포를 결합한 CAR-NK 세포치료제다.
아티바는 지난해 미국면역항암학회(SITC)에서 AB-201이 유방암에 걸린 동물 모델에서 엔허투의 성분인 트라스투주맙에 비해 높은 생존 이득을 보였다고 발표하기도 했다.
셀트리온도 지난 21일 미국 바이오 기업 '에이비프로'(Abpro)와 HER2 발현 유방암 등에 쓰이는 이중항체 치료제 'ABP102'에 대한 공동 개발 계약을 체결했다고 밝혔다.
지난 16일 항체 신약 개발기업 앱클론도 중국 바이오 기업에 기술 이전을 한 HER2 발현 위암 등에 대한 항체치료제 'AC101'의 임상 2상 중간 결과에서 효과를 확인했다고 밝혔다.
임상은 AC101과 기존에 허가된 항암제의 바이오시밀러(바이오의약품 복제약)를 병용 투여하는 방식으로 진행됐다.
그 결과 부분적으로 반응한 환자 비율인 객관적 반응률(ORR)이 85% 이상으로 예측된다고 회사는 설명했다.
보건복지부 최근 조사에 따르면 유방암은 2019년 여성에서 가장 많이 발생한 암이다.
위암은 남녀 전체에서 세 번째로 많이 발생한 암인 것으로 나타났다.