FDA
-
한미약품 기술수출한 폐암 신약, 美 FDA서 시판승인 절차 시작
신약 시장의 ‘노른자’로 꼽히는 미국 항암제 시장에 국산 신약 진출 가능성이 열렸다. 한미약품이 미국 제약사에 기술이전한 비소세포폐암 치료제 ‘포지오티닙’이 시판 허가를 위한 평가 절차에 들어갔다.한미약품은 “미국 식품의약국(FDA)이 포지오티닙의 신약허가신청서(NDA)를 승인하고 시판 승인을 위한 절차...
2022.02.13 17:53
-
메드트로닉, 하지정맥류 치료기 '뉴베나실' 출시
메드트로닉코리아가 하지정맥류 치료용 의료기기 ‘뉴베나실’(사진)을 출시했다고 7일 밝혔다.뉴베나실은 2017년 1월 국내에 출시됐던 베나실을 업그레이드한 신제품이다. 베나실은 2015년 미국 FDA(식품의약국)의 승인을 받았으며 국내에선 식품의약품...
2022.02.07 11:22
-
씨엔알리서치, WRRS와 美 임상 승인 업무협약 체결
씨엔알리서치는 미국 식품의약국(FDA) 인허가 자문(컨설팅) 전문기업인 ‘WRRS’와 업무협약(MOU)을 체결했다고 7일 밝혔다. WRRS는 씨엔알리서치가 의뢰받은 미국 임상시험계획(IND) 승인과 관련된 일부 업무를 대행할 계획이다. 씨...
2022.02.07 11:16

-
FDA, 美 디날리 테라퓨틱스 알츠하이머 치료제 1상 보류
미국 제약사 디날리 테라퓨틱스는 지난 13일(현지시간) 미국 식품의약국(FDA)으로부터 ‘DNL919’의 1상 임상시험계획(IND) 신청에 대해 승인 보류 통보를 받았다고 발표했다. DNL919는 골수세포에서 발현되는 ‘TREM...
2022.01.14 08:23

-
SD바이오센서, 자가진단키트 美판매 허가
SD바이오센서가 개발한 코로나19 자가진단키트가 미국에서 판매 허가를 받았다.스위스 제약·의료기기 기업인 로슈는 신속 자가 항원진단키트인 ‘코비드19 앳홈테스트’가 미국 식품의약국(FDA)에서 긴급사용승인(EUA)을 받았다고 지난 24일 발표했다. 이 제품은 SD바이오센서가 생산해 로슈에 납품하고 있다. 오미크론 변이를 포...
2021.12.26 17:29
-
인트론바이오, 진단추출제품 美 FDA 의료기기 등록
인트론바이오는 코로나19 진단키트와 관련해 유전자를 대량으로 추출할 수 있는 진단추출장비(Miracle-AutoXT Automated Nucleic Acid Extraction Kit) 및 진단추출키트(AutoXT PGS Extraction Kit) 등 진단추출제품이 ...
2021.11.23 11:00

-
루닛, 국내 최초 AI 유방암 검출 솔루션 美 FDA 허가
루닛은 인공지능(AI) 유방암 진단보조 솔루션 '루닛 인사이트 MMG'가 미국 식품의약국(FDA)으로부터 허가받았다고 18일 밝혔다. 국내 유방암 검출 AI 솔루션이 FDA 허가를 획득한 것은 이번이 처음이다.이 제품은 AI를 기반으로 유방촬영술(Mamm...
2021.11.18 13:42
-
셀리버리 “코로나19 치료제, 美 FDA와 임상신청 전 회의 개시”
셀리버리는 코로나19 치료제 후보 ‘iCP-NI’의 미국 임상시험을 위해 미 식품의약국(FDA)과 임상시험 신청 전 회의(pre-IND meeting)를 개시했다고 18일 밝혔다.기존에는 FDA에 임상시험 신청 시 임상 시놉시스(Clinical S...
2021.11.18 10:39
-
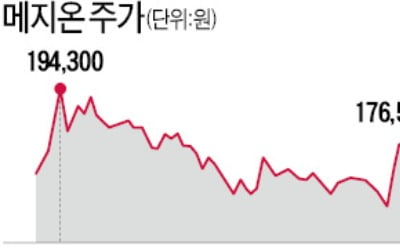
메지온의 자신감 "FDA 불허 땐 이자 더 준다"
메지온이 미국 식품의약국(FDA) 신약허가를 조건으로 걸고 200억원을 조달했다. 시장에선 FDA 신약허가 심사를 받고 있는 메지온이 강한 자신감을 드러내고 있다고 보고 있다.17일 금융감독원 전자공시시스템에 따르면 메지온은 지난 12일 타이거자산운용이 운용하는 사모펀...
2021.11.17 17:54
-
"FDA 허가 못 받으면 이자 올려줄게"…200억 조달한 메지온의 자신감
메지온이 미국 식품의약국(FDA) 신약허가를 조건으로 걸고 200억원을 조달했다. 시장에선 FDA 신약허가 심사를 받고 있는 메지온이 강한 자신감을 드러내고 있다고 보고있다.17일 금융감독원 전자공시시스템에 따르면 메지온은 지난 12일 타이거자산운용이 운용하는 사모펀드들에 하이브리드 전환사채(CB)를 발행해 200억원을 조달했다. CB의 표면·...
2021.11.17 15:59
-
화이자, 먹는 코로나19 치료제 美 긴급사용승인 신청
화이자가 미국 식품의약국(FDA)에 먹는(경구용) 코로나19 항바이러스 치료제 ‘팍스로비드’(성분명 리토나비르)의 긴급사용승인(EUA)을 신청했다고 16일(현지시간) 밝혔다. 팍스로비드가 FDA로부터 승인받으면 최초의 경구용 &#...
2021.11.17 08:21

-
루닛, AI 응급질환 자동분류 솔루션 美 FDA 허가
루닛은 인공지능(AI) 영상분석 솔루션 '루닛 인사이트 CXR 트리아지'가 미국 식품의약국(FDA)으로부터 허가받았다고 15일 밝혔다.이 제품은 폐결절과 폐경화 등 9가지 폐 질환 영상분석 솔루션인 '루닛 인사이트 CXR'과 별도로 기흉과 ...
2021.11.15 13:48
-
의료AI 스타트업 루닛, 美 FDA 뚫었다
의료 인공지능(AI) 스타트업 루닛이 흉부 응급질환 판독 솔루션으로 미국 식품의약국(FDA) 허가 관문을 통과했다. 루닛의 세계 의료 시장 진출 속도가 빨라질 것으로 기대된다. 루닛은 '루닛 인사이트 CXR 트리아지'가 FDA로부터 허가...
2021.11.15 11:01
-
지아이이노베이션, '유니콘 특례' 코스닥 상장
바이오 기업 지아이이노베이션이 ‘시장 평가 우수기업 특례(유니콘 특례)’로 코스닥시장 입성에 도전한다.지아이이노베이션은 유니콘 특례를 위한 기술성 평가를 통과했다고 4일 발표했다. 이 회사는 적자여도 성장 잠재력이 크다고 평가받은 기업에 상장 기회를 주는 ‘성장성 특례상장’을 추진하다가 한국거래소가 지난 4월 유니...
2021.11.04 17:54
-
美 FDA, 5~11세 대상 화이자 백신 접종 긴급 승인
미국 식품의약국(FDA)이 5~11세를 대상으로 한 화이자 코로나19 백신 접종을 긴급 승인했다.31일 로이터통신 등에 따르면 FDA는 지난 29일 백신·생물의약품자문위원회(VRBPAC)의 권고에 따라 5~11세에게 화이자 백신을 접종해도 좋다고 밝혔다. ...
2021.10.31 13:41
-
카이노스메드, 파킨슨병 치료제 美 FDA 임상 2상 신청
카이노스메드는 자회사 패시네이트 테라퓨틱스를 통해 파킨슨병 치료제 ‘KM-819’에 대한 임상 2상을 미국 식품의약국(FDA)에 신청했다고 18일 밝혔다. 임상 2상은 환자 288명에게 약물을 2년 간 투여한 후 효능을 평가하는 방식으로 ...
2021.10.18 10:27

-
모더나 “코로나 백신 부스터샷 필요”…美 FDA, 이번주 논의
모더나가 자사의 코로나19 백신의 효능이 시간이 지남에 따라 약화한다며 추가접종(부스터샷)을 승인해달라고 요청했다. 미국 식품의약국(FDA)은 이주 회의를 열고 부스터샷이 필요한지를 논의할 예정이다.12일(현지시간) 외신 보도에 따르면 미국 식품의약국(FDA)은 이 같...
2021.10.13 08:05
-
화이자, FDA에 5~11세 대상 백신 긴급사용승인 신청
화이자와 바이오엔테크는 7일(현지시간) 미국 식품의약국(FDA)에 5~11세 아동을 위한 코로나19 백신의 긴급사용승인을 신청했다고 밝혔다. 미국 내 대상자는 2800만명에 이를 것으로 추산된다. FDA 백신 자문단은 오는 26일 회의를 열고 승인 여부를 논의할 예정이다.백악관 백신 대응 담당자는 “내달 25일 전후로 있을 추...
2021.10.08 07:57
-
에스티큐브 “FDA와 항체신약 임상신청 사전 회의 완료"
에스티큐브는 미국 식품의약국(FDA)과 ‘BTN1A1’을 표적하는 항체신약 ‘hSTC810’의 임상 신청 전 회의(Pre-IND)를 완료했다고 30일 밝혔다. 연내 FDA에 임상 1상을 신청할 계획이다. BTN1A1은...
2021.09.30 09:44

-
美 FDA 위원회 "화이자 부스터샷 반대…부작용·효능 대비 실익 안 커"
미국 식품의약국(FDA) 자문위원회가 코로나19 백신 부스터샷(추가 접종)에 반대 의견을 냈다. 백신 부작용에 대한 입증이 아직 충분치 않고 2차 접종까지만으로도 효과가 충분한 상황에서 굳이 부스터샷까지 필요가 없다는 것이 결정의 요지다. 위원회의 의견에 미국 증시에서 관련주의 주가는 일제히 하락했다. FDA 자문기구인 백신·...
2021.09.18 07:34
AD