삼성 바이오사업, 4년 만에 첫 성과
입력
수정
지면A18
삼성바이오에피스 '엔브렐 바이오시밀러' 유럽에 첫 허가 신청
2016년 현지 판매 추진…빅5 바이오시밀러도 개발 중

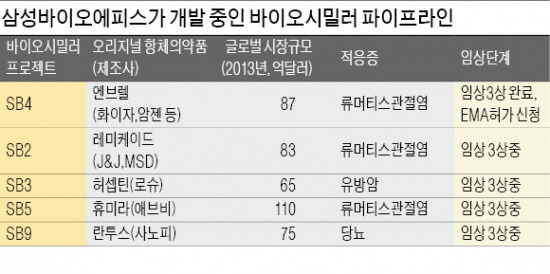
EMA는 14개월간 심사를 거쳐 최종 판매 허가 여부를 결정한다. 삼성은 2016년에는 SB4를 유럽 현지에서 판매할 수 있을 것으로 기대하고 있다. 다국적 제약사 화이자가 개발한 엔브렐은 지난해 세계시장에서 9조5000억원어치가 팔린 초대형 의약품이다. 삼성의 허가신청은 오는 2월 유럽에서 엔브렐 특허가 만료되는 점을 겨냥한 것이다.엔브렐의 바이오시밀러 허가를 EMA에 신청한 것은 삼성바이오에피스가 처음이다.
◆삼성 바이오사업 첫 성과
이번 EMA 허가 신청은 삼성이 2011년 2월 바이오시밀러 사업을 시작한 뒤 내놓은 첫 결과물이다. 삼성은 2011년 항체의약품 생산을 대행하는 ‘삼성바이오로직스’ 설립에 이어 2012년 2월 바이오시밀러를 개발하는 ‘삼성바이오에피스’를 세우고 공격적인 투자에 나섰다. 당시 삼성은 ‘바이오시밀러를 미래 성장산업으로 키우겠다’는 전략에 따라 2조1000억원 투자계획을 내놨다.
EMA는 SB4의 임상시험 데이터에 대한 2주간 사전검토 작업 끝에 본격적인 심사 착수를 결정했다. 고한승 삼성바이오에피스 대표는 “이번 SB4의 판매허가 신청은 삼성 바이오사업의 첫 성과라서 의미가 남다르다”고 말했다.
◆바이오 승부수삼성바이오로직스는 현재 짓고 있는 연산 15만L급 2공장이 내년에 완공되면 출범 5년 만에 18만L급 바이오의약품 생산시스템을 갖추게 된다. 단숨에 론자, 베링거잉겔하임에 이어 글로벌 3위로 도약하게 된다.
삼성바이오에피스는 글로벌 ‘빅5’ 항체의약품 바이오시밀러를 동시에 개발하는 초유의 시험에 도전하고 있다. 엔브렐뿐만 아니라 세계에서 가장 많이 팔리는 ‘휴미라’를 비롯해 ‘레미케이드’ ‘란투스’ ‘허셉틴’의 바이오시밀러 임상시험 3상을 진행하고 있다. 이들 항체의약품 ‘빅5’의 2013년 매출은 45조원에 달했다.
삼성바이오에피스는 연내 레미케이드와 휴미라의 바이오시밀러에 대한 EMA 허가 신청이 가능할 것으로 내다보고 있다. 고 대표는 “임상 결과가 좋기 때문에 기대가 크다”며 “올해가 국내 바이오산업에 새로운 전기가 될 수 있을 것”이라고 기대감을 보였다.
김형호 기자 chsan@hankyung.com