10여년째 항체 복제약으론 빛 못봤지만…이수앱지스, 항암신약 시장서 반전 노린다
입력
수정
지면A20
1세대 항체치료제 기업
고셔병 등 희귀질환 복제약 3종
국내 선방했지만 해외선 부진
신약개발사로 변신 서둘러
표적·면역항암제 속속 임상 착수
혈우병 치료제도 美 3상 앞둬

희귀질환 치료제 해외에선 성과 못내
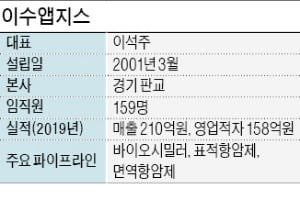
국내 유일한 항혈전 항체 치료제인 클로티냅을 2006년 출시했다. 셀트리온의 항체 바이오시밀러 램시마보다 6년 빨랐다. 고셔병 치료제 애브서틴과 파브리병 치료제 파바갈은 국내 시장(환자 수 기준)의 30% 정도를 차지하고 있다. 국내 고셔병 환자는 70여 명, 파브리병 환자는 200여 명이다. 세 약물은 오리지널 제품의 특허가 만료된 뒤 개발한 바이오시밀러지만 당시 국내에선 바이오시밀러 인허가 제도가 미비해 희귀의약품으로 허가받았다.
미국 바이오기업 카탈리스트와 혈우병 신약 ISU304도 공동 개발하고 있다. 세계 최초의 피하주사형 혈우병 치료제다. 카탈리스트가 개발한 후보물질의 세포주와 공정을 개발하고 임상 1상을 마친 뒤 임상 2상부터는 카탈리스트가 담당하는 방식이다. 미국에서 임상 2상을 마치고 임상 3상을 준비 중이다.
항암제 개발에 매출 70% 투자
이수앱지스는 2010년대 초부터 항암제 쪽으로 진출했다. 표적항암제 ISU104가 대표적 파이프라인(후보물질)이다. ISU104는 두경부암 대장암 유방암 등에 많이 발현되는 단백질인 ErbB3에 작용한다. 이 대표는 “암 증식과 전이에 관여하는 ErbB3가 제 기능을 못 하도록 막는다”고 설명했다.ErbB3를 타깃으로 하는 표적항암제는 아직 없다. 글로벌 제약사 머크의 얼비툭스는 ErbB1 단백질을 타깃으로 하는데 내성이 생길 경우 대안이 없다. ISU104는 얼비툭스 내성 환자를 치료하는 게 목표다. 그는 “얼비툭스 연매출은 2조원에 달한다”며 “얼비툭스에 내성이 생긴 두경부암 환자의 2차 치료제로 개발할 것”이라고 했다.
연내 美 FDA에 임상 2상 신청
이수앱지스는 국내에서 임상 1상을 마치고 임상 결과를 공개할 예정이다. 올해 미국 식품의약국(FDA)에 임상 2상을 신청한다. 면역항암제도 개발 중이다. 면역세포 표면에 있는 단백질인 CD-47을 건드리면 선천 면역세포의 일종인 대식세포가 신호를 받아 암세포를 잡아먹는 후보물질을 연구하고 있다. 그는 “미국 길리어드사이언스가 CD-47 항체 기반 후보물질을 6조원에 도입했는데 기전이 불명확해 개발이 중단됐다”며 “최근 원리가 밝혀지면서 어떤 방향으로 개발할지 논의 중”이라고 했다.면역반응을 강하게 유발해 사이토카인 폭풍 위험이 큰 신호전달물질인 인터페론-베타에 항체를 붙여 안전성을 높인 면역항암제도 보유하고 있다. 이 대표는 “항암제 연구개발에 매출의 70%가량을 투자하고 있다”고 했다.
임유 기자 freeu@hankyung.com