셀트리온헬스케어, 1~3분기 매출 1조2406억원…지난해 매출 이미 뛰어넘었다
입력
수정
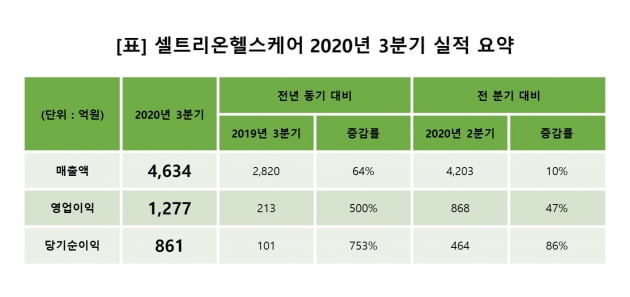
셀트리온헬스케어는 3분기 매출액 4634억원, 영업이익 1277억원을 기록했다고 16일 발표했다. 전년 동기 대비 각각 64%, 500% 올랐다. 지난 2분기 실적인 매출액 4203억원, 영업이익 868억원을 뛰어넘었다. 영업이익률은 28%에 달했다.증권업계는 당초 3분기 영업이익을 951억원으로 예상했지만 셀트리온은 시장 기대보다 34.2% 많은 영업이익을 거뒀다. 지난 1~3분기 누적 매출액은 1조2406억원으로 지난해에 기록했던 매출액 1조1009억원을 이미 뛰어넘었다.
이번 어닝 서프라이즈는 트룩시마가 미국 시장에 빠르게 안착한 것이 주 요인으로 꼽힌다. 트룩시마는 바이오젠이 개발하고 로슈가 판매하는 혈액암 치료제 ‘리툭산’의 바이오시밀러다. 리툭시맙이 주성분인 트룩시마는 지난해 11월 미국서 출시된 이후 10개월 만인 지난 9월 시장 점유율 20.4%를 달성했다. 제품 경쟁력과 더불어 북미 지역 협력사인 테바의 마케팅, 유통 전략이 주효했다는 게 회사 측의 설명이다. 유럽에선 지난 2분기 기준 리툭시맙 치료제 시장에서 점유율 37%를 기록하며 오리지널 의약품인 리툭산의 점유율 36%를 뛰어넘었다.
아시아에서의 성과도 두드러졌다. 셀트리온헬스케어는 일본에서 지난해 8월 허쥬마(성분명 트라스투주맙)가 유방암 3주요법으로 판매 허가를 받은 이후 1년여 만인 지난 3분기에 시장 점유율 39%을 기록했다. 회사 관계자는 “허쥬마 출시 이후 브랜드 인지도가 높아지면서 먼저 시장에 진출한 램시마 점유율도 함께 상승하고 있다”고 말했다. 당분간 실적 개선이 계속되리란 전망이 나온다. 램시마를 피하주사(SC) 제형로 개발한 제품인 램시마SC가 지난 7월 전체 적응증에 대해 유럽의약품청(EMA)에서 허가를 획득하고 출시 국가를 늘리고 있어서다. 신종 코로나바이러스 감염증(코로나19) 감염 우려 없이 자가투여가 가능하다는 장점 덕분에 병원에 가는 횟수를 줄일 수 있어 환자들의 처방 선호도도 높다.
셀트리온헬스케어 관계자는 “자가면역질환 치료제인 휴미라의 바이오시밀러 ‘CT-P17’도 유럽에서 승인 절차를 진행 중이다”며 “후속 제품 출시로 지속적인 실적 성장이 가능할 것”이라고 말했다.
이주현 기자 deep@hankyung.com