"첫 'KRAS' 억제제 FDA 승인…국내 개발업체는 나이벡"
입력
수정
암젠 루마크라스 신약허가
나이벡 전임상 중
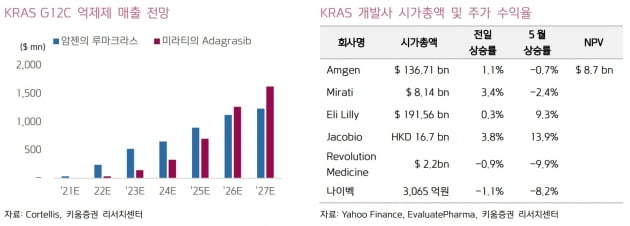
31일 키움증권에 따르면 암젠은 지난 1월 루마크라스의 신약승인을 FDA에 신청했다. 전문의약품 허가 신청자 비용부담법(PDUFA)에 따라 최종 결정 기한을 오는 8월 16일로 받았으나, 이보다 2~3달 앞선 이달 28일(현지시간) FDA에서 첫 KRAS 억제제로 승인받았다.KRAS는 세포의 성장과 분열을 도와주는 유전자 변이다. 루마크라스는 'KRAS G12C' 돌연변이 국소 진행성 또는 전이성 비소세소폐암(NSCLC)의 2차 치료제로 허가받았다.
허혜민 키움증권 연구원은 "보통 신약 개발에 10~15년 걸리나, 루마크라스는 임상 진입 3년도 안 돼 이룬 성과"라며 "KRAS G12C 변이 환자 대상 치료제가 없는 등 '퍼스트 무버' 전략 때문"이라고 판단했다.
KRAS 변이는 비소세포폐암에서 25% 발현된다. 이 중 KRAS G12C 변이는 비소세포폐암 변이의 13%를 차지하고 있다는 설명이다. 루마크라스는 면역요법 치료와 화학 요법을 받았던 124명의 환자를 대상 객관적반응률(ORR) 36%를 기록했다. 루마크라스의 FDA 승인으로 KRAS 억제제 시장이 열렸다. 후발 주자들은 루마크라스 대비 내성 효능 안전성 등에서 개선된 약물을 신속하게 개발할 필요가 있다고 봤다. 긍정적인 점으로는 루마크라스가 FDA 승인을 받으면서, 후발 주자들에게 KRAS 억제제 개발에 관한 방향이 제시됐다는 것이다. 후발 주자들은 대부분 전임상 중으로 임상 진입 시 루마크라스를 기준으로 해 개발에 속도를 낼 것으로 기대했다.
허 연구원은 "루마크라스의 신약 가치는 87억 달러로 평가되고 있고, 미라티는 주요 후보물질 아다그라십으로 현재 시가총액이 80억 달러에 형성돼 있다"며 "KRAS 억제제 승인 및 후발 주자들의 가치는 대략 9조~10조원 수준"이라고 했다.
국내 관련 업체로는 나이벡을 꼽았다. 나이벡은 표적 단백질 분해유도 시스템을 기반으로 KRAS G12C 억제제의 전임상 단계에 있다. 내년 말이나 2023년 초에 임상에 진입할 예정이다.
한민수 기자