[Cover Story - part.1 Analysis] 자가면역질환은 왜 발생하는가
입력
수정
글 곽승기 서울성모병원 류마티스내과 교수면역이란 자기(self)와 비자기(non-self)를 구분하는 피아 식별의 과정이다. 이 과정의 이상으로 면역관용이 소실돼 자신의 몸을 면역계가 공격하는 상태를 자가면역질환이라 한다. 공격 범위는 루푸스처럼 온몸이기도 하고, 자가면역성 갑상선염처럼 특정 장기의 세포에 국한되기도 하며, 류머티즘 관절염처럼 양쪽 모두에 해당되는 경우도 있다. 자가면역질환의 발생 기전은 아직도 많은 연구와 이해가 필요한 상태이나 류머티즘 관절염과 루푸스의 예를 들어 이해를 도모해보자.
대표적 자가면역질환, 류머티즘 관절염
류머티즘 관절염은 몸의 양측에 대칭적·다발적으로 발생하는 만성 관절염을 특징으로 하는 대표적 자가면역질환이다.
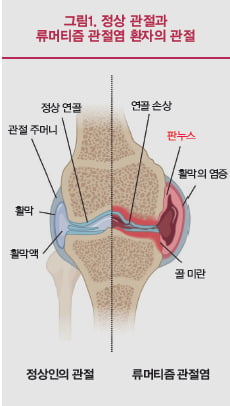
많은 사람들이 류머티즘 관절염을 관절에만 국한되는 질병으로 알고 있지만 피부, 폐, 심장, 말초신경, 혈관, 눈, 콩팥 등 전신을 침범하기도 하고, 셰그렌증후군 같은 다른 자가 면역질환의 발생과도 연관이 있다.
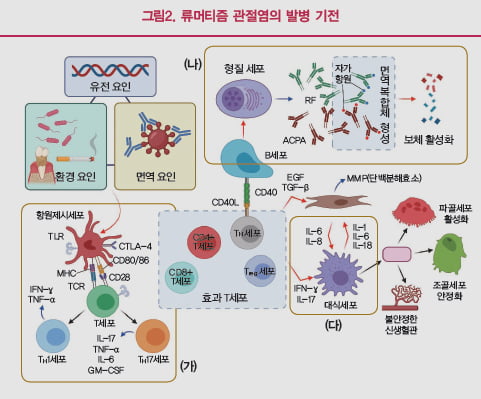
형질세포가 만들어낸 RF(Rheumatoid Factor·류머티즘 인자), ACPA(Anti-Citrullinated Peptide Antibody) 등과 같은 자가면역항체는 항원과 반응해 면역 복합체를 형성하고 보체를 활성화하면서 염증 반응을 증폭시킨다. 더불어 분화된 Th세포들은 각종 사이토카인을 분비한다(그림 2 <나>).
이제 효과T세포(Effector T Cell)라 불리는 여러 세포들이 지원병력으로 출동한다. 효과T 세포는 대식세포와 활막섬유모세포를 자극하고, 자극된 대식세포와 활막섬유모세포는 TNF-α, IL-1, IL-6과 같은 사이토카인과 GM-CSF 같은 염증 매개인자들을 분비하여 병이 더욱 진행된다(그림 2 <다>).
류머티즘 관절염의 병인 관련 인자들
TNF-α는 T세포와 B세포의 증식을 촉진하고, 활막세포를 활성화하여 단백분해효소를 생산한다. 더불어 불안정한 신생혈관들을 만들며, 조골세포를 안정화하고 파골세포를 활성화해 골소실을 유도한다. TNF-α를 표적으로 하는 엔브렐(성분명 에타너셉트), 레미케이드(인플릭시맙), 휴미라(아달리무맙), 심포니(골리무맙), 심지아(세르톨리주맙) 등 여러 가지 생물학적 제제들이 2000년대 중반부터 널리 사용되고 있고, 환자의 증상 호전 및 방사선학적 진행을 억제하는 등 효과가 우수해 류머티즘 관절염 치료의 패러다임을 변화시켰다.
Th세포가 분비하는 사이토카인에는 TNF-α 이외에도 인터페론(IFN)-γ, 각종 인터루킨(IL) 계열의 사이토카인, GM-CSF 등이 있다. IL-6을 표적으로 하는 생물학적 제제로는 악템라(토실리주맙) 등이 FDA의 승인을 받아 사용되고 있다.
염증 및 자가면역에 관여하는 면역세포의 내부에는 외부의 자극을 전달하는 여러 가지 경로가 존재한다. JAK-STAT, MAPK, PI-3k/AKT 같은 세포내 신호경로가 류머티즘 관절염 환자에게서 왜곡되어 있으며, 이를 차단하는 JAK1/3억제제(토파시니티닙)나 JAK1/2억제제(바리시티닙)가 류머티즘 관절염 치료에 효과가 입증되어 사용되고 있다.
최근에는 이런 JAK억제제의 선택성을 높인 JAK1억제제(우파다시티닙) 역시 개발되어 류머티즘 관절염 치료에 이용되고 있다. T세포의 CD28이 항원제시세포의 CD80/86과 결합하여 T세포가 활성화되면, T세포 표면에 CTLA-4라는 새로운 물질이 발현된다. CTL A-4와 CD80/86의 결합은 T세포를 비활성화 시킨다. 이런 CTLA-4의 구조 일부(효과기)만을 합성한 치료제(아바타셉트)가 임상에서 사용되고 있다.
류머티즘 관절염 환자의 활막세포는 암세포처럼 과도한 증식을 하게 된다. 종양억제유전자인 p53의 돌연변이가 이와 같은 활막의 과활성 및 세포자멸사(apoptosis) 저항성에 관여한다.
천(千)의 얼굴을 가진 병, 루푸스
루푸스(전신홍반루푸스)란 조직결합 자가항체와 면역복합체로 인해 발생하는 염증 반응과 이로 인한 다양한 장기 손상을 주요 소견으로 하는 자가면역질환이다. 어떤 기관과 조직을 공격하느냐에 따라 피부, 관절, 신장, 폐, 신경 등 전신의 여러 부위에서 염증 반응이 나타나게 된다. 따라서 같은 루푸스 환자라 하더라도 질병의 양상이 달라질 수 있어 ‘천(千)의 얼굴을 가진 병’이라 부른다.
루푸스 환자에서는 다양한 유전적·면역적· 환경적 요인들이 복합적으로 관여해 핵산과 같은 자기(self)가 면역관용을 잃고 자가항원으로서 작용하게 된다. 그리고 이 자가항원을 목표로 하는 자가항체가 형성되어 면역복 합체를 생성하고, 이는 보체를 활성화하며 염증세포를 소집한다. 소집된 염증세포는 여러 염증성 사이토카인을 분비하며 병을 진행시킨다.
더불어 자가항체는 면역복합체 형성 없이도 직접 세포를 공격하여 세포의 기능적 이상을 초래하거나 세포 자체를 파괴하기도 한다. 루푸스의 발병에 관여하는 요인들은 너무나도 많고 복합적이다. 크게 다섯 가지로 묶어 살펴보도록 하겠다.
1. 유전적 요인
첫 번째는 유전적 요인이다. 유전자가 동일한 일란성 쌍둥이에서 루푸스 발생의 연관율은 14~57%로, 이란성 쌍둥이의 3%에 비해 매우 높다.
루푸스 환자의 가족에서 새로운 환자가 생길 확률은 5~12%이며, 이는 일반인에 비하 면 100배가량 높은 수치다. HL A-DR2와 HLA-DR3 유전자는 각각 발병 위험도를 2배 정도 증가시킨다. 빈도는 극히 드물지만 보체 유전자의 결핍도 위험도를 5~25배 상승시킨다. 100여 개의 유전자가 루푸스 발병 과 관련되어 있다고 알려져 있다.
2. 세포사멸 기전 이상
두 번째 요인은 세포사멸 기전에 생기는 이상이다. 세포분열의 횟수가 많이 누적된 세포는 세포자멸사라는 과정을 통해 스스로 분해된다.
세포자멸사의 결과, 세포의 잔해는 소체로 불리는 주머니에 깔끔하게 포장되고, 대식세포가 이를 수거하여 재활용하는 것이 정상이다. 그러나 루푸스 환자의 대식세포는 이를 제대로 수거하지 못해 2차 괴사가 일어나고, DNA 같은 세포 내 내용물들이 노출돼 자가항원이 된다.
새로운 B세포와 T세포가 태어난 뒤 성숙하는 과정에서 아군을 공격하지 않도록 거치는 여러 검수 과정에 문제가 생길 경우 자가 항원을 인식하는 잘못된 면역세포들이 혈액에 유출되기도 한다.
3. 면역학적 요인
세 번째는 면역학적 요인이다. 선천 면역계 세포의 수용체인 톨유사수용체(TLR) 중에서 TLR7, TLR9는 각각 RNA, DNA를 인식한다. TLR의 이상으로 RNA, DNA 같은 핵산 복합체에 대한 자가항체가 형성될 수 있다.
보체의 이상 또는 IFN-α, TNF-α 등의 사이토카인 역시 루푸스와 연관되어 있다. TLR의 활성 및 IFN 자극은 B세포를 자극하는 BAFF(B세포 활성인자)를 발현한다. BAFF는 다시 양성 되먹임으로 TLR 활성을 촉진하여 질병을 진행시킨다. 2011년에는 이러한 BAFF를 타깃으로 하는 약제(벨리무밥)가 개발되어 FDA 승인을 받았으며, 현재 국내에서도 처방이 가능하다.
루푸스 환자의 T세포는 B세포를 과도하게 자극하고, 과장된 염증 반응을 일으킨다. 반면 JAK-STAT, MAPK, PI-3k/AKT와 관계되어 면역을 조절하고, 자가면역반응을 억제하는 IL-2는 적게 생성한다. 루푸스 환자의 혈청에는 IL-17이 증가되어 있으며 CD4- CD8- T세포들이 증가하고, 면역반응을 조절하는 조절T세포의 수와 기능이 저하되어 있다는 것 역시 확인됐다.
4. 호르몬 요인
네 번째 요인은 호르몬이다. 여성 호르몬인 에스트라디올(estradiol)은 T세포 와 B세포의 생존능 및 활성을 높이고, 대식 세포를 자극하며, 자가면역 B세포의 사멸을 억제한다.
반면 남성호르몬인 디하이드로에피안드로스테론(DHEA·Dehydroepiandrosterone)은 면역억제의 효과를 지니며, 대부분의 루푸스 환자에게서 혈중 농도가 낮아져 있다.
경구 피임약의 복용, 호르몬 대체요법, 빠른 초경 등으로 인한 과다한 여성호르몬 노출이 루푸스의 발병 위험을 약 2배까지 높이는 것으로 알려져 있다. 출산 이후 수유를 할 경우 루푸스 발병 위험을 낮춘다는 연구결과 역시 성호르몬과 루푸스 발병 간 연관성을 뒷받침한다.
5. 환경적 요인
마지막으로 환경적 요인이다. 각종 세균 및 바이러스 감염이 루푸스의 발병과 연관이 있다고 알려져 있다. 자외선도 각질 세포를 자극하여 사이토카인 분비를 통해 자가항체를 생성하고, 대식세포를 자극하며, T세포가 자가면역성을 띠도록 유도한다.
이 외에도 이산화규소 분진이나 흡연이 루푸스의 발병 위험을 높인다고 알려져 있다. 항결핵제나 혈압약, 항생제 등 일부 약물에 의해서도 약제 유발 루푸스가 발생하기도 한다. 이 경우는 해당 약제 복용을 중단하면 루푸스 증상이 없어진다.
<저자 소개>
가톨릭대 의대 졸업 후 동 대학원에서 석·박사학위를 마쳤다. 2014년 4월부터 가톨릭대 서울성모병원 교수로 재직 중이다.
*이 글은 <한경바이오인사이트> 매거진 2021년 7월호에 실렸습니다.