AZ, ‘NKG2A’ 면역관문억제제 ‘모날리주맙’ 두경부암 3상 실패
입력
수정
[최지원의 바이오톡(talk)]폐암 3상은 진행 중
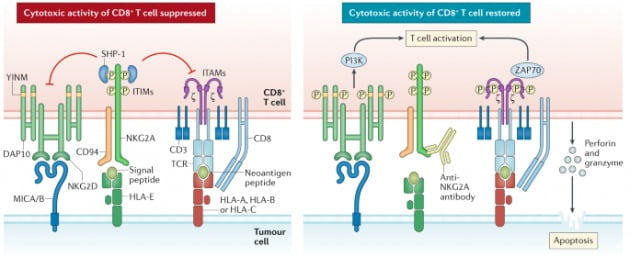
1일(현지시간) 아스트라제네카는 백금 기반 화학요법으로 치료를 받은 적이 있는 재발성 또는 전이성 두경부암 환자를 대상으로 한 3상 연구(INTERLINK-1)의 중간 분석에서 1차 평가변수를 충족하지 못했다고 밝혔다. 회사는 독립적 데이터 모니터링 위원회(IDMC·Independent Data Monitoring Committee)의 권고에 따라 임상 중단을 결정했다.이번 연구에서는 모날리주맙과 세툭시맙의 병용치료와 세툭시맙 단독 치료의 효능을 비교했다. 그 결과 통계적으로 유의한 개선 효과를 확인하지 못했다. 세툭시맙은 두경부암 환자에게 주로 처방되는 'EGFR' 표적치료제다. 구체적인 임상 데이터는 공개하지 않았다.
모날리주맙은 아스트라제네카가 프랑스의 인네이트 파마와 함께 공동개발한 'NKG2A' 항체다. NKG2A는 면역세포의 표면에 솟아있는 막 관통 단백질로, 면역반응을 억제하는 역할을 한다. 'PD-1'과 같은 면역관문(immune checkpoint)의 일종이다.
PD-1은 면역세포 중 T세포에만 발현돼 있다. 반면 NKG2A는 T세포와 NK세포에서 모두 발현돼 있어, 암세포의 면역회피를 효과적으로 막을 수 있을 것으로 예상되는 주요 표적이었다. 인네이트가 진행했던 모날리주맙의 임상 2상에서는 이전에 화학요법 혹은 화학요법과 면역관문억제제 치료를 받은 두경부암 환자 40명에서 27.5%의 반응률을 보였다. 또 2번의 전신 요법을 받고 백금 기반 화학요법 및 면역관문억제제 치료를 받은 환자 40명에서도 20%의 반응률을 보였다. 세툭시맙을 단독으로 치료하는 경우 반응률은 12.6% 수준이다. 당시 업계에서는 모날리주맙의 임상 2상 결과를 두고 ‘고무적’이라고 평가하며, 임상 3상 결과를 기대했지만 결국 실패로 돌아갔다.
2020년부터 시작된 모날리주맙의 임상 3상은 약 600명의 환자를 대상으로 진행할 계획이었다. 그러나 IDMC의 임상 중단 권고로 조기 중단을 결정했다.
아스트라제네카는 두경부암을 대상으로 하는 임상은 중단했지만 비소세포폐암에 대한 임상 3상(PACIFIC-9)은 예정대로 진행할 계획이라고 했다. 현재 아스트라제네카와 인네이트는 절제가 불가능한 3기 비소세포폐암 환자를 대상으로 모날리주맙과 임핀지의 병용치료 효과를 평가 중이다. 몬데르 마주비 인네이트 대표는 “비록 두경부암 임상은 실패했지만 안전성에 대한 문제는 보고되지 않았다”며 “비소세포폐암의 임상 2상 결과가 매우 좋기 때문에, 임상 3상에서 역시 모날리주맙이 좋은 효과를 보일 것이라고 기대한다”고 말했다.
지난해 공개한 임상 2상 결과에 따르면 10개월간 무진행생존율(PFS rate)은 임핀지와 모날리주맙 병용이 72.7%였다. 임핀지 단독 치료는 39.2%에 그쳤다. 비소세포폐암의 임상 3상은 999명의 환자를 대상으로 진행되며 2026년 종료될 예정이다.
이번 두경부암 임상 3상 실패 소식이 알려지자 인네이트의 주가는 20% 가량 급락했다. 인네이트는 올해 들어 현재까지 약 40% 이상 주가가 하락한 상태다.
최지원 기자 jwchoi@hankyung.com