美바이킹, NASH 2b상 중간결과서 1차 유효성 기준 충족
입력
수정
10mg 투여군의 85%에서 지방간 30%↓
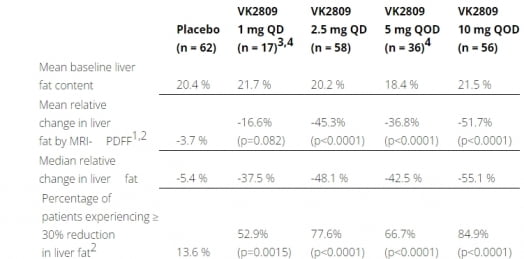
VK2809의 2b상은 조직생검으로 확인된 NASH 환자 최대 337명을 대상으로 진행 중이다. 환자들에게 1mg 2.5mg 5mg 10mg의 VK2809 혹은 위약을 투여했다. 1차 유효성 평가지표는 자기공명영상 양자밀도 지방비율(MRI-PDFF)로 측정한 12주차 지방간 함량(liver fat content)이다. 중간 결과에서는 VK2809 및 위약의 투여 전(baseline) 대비 지방간 함량을 비교했다.
그 결과 VK2809를 투여받은 환자는 위약 투여군에 비해 통계적으로 유의미하게 지방간이 감소했다.
지방간 변화의 대한 중앙값은 1mg 투여군 -16.6%, 2.5mg -45.4%, 5mg -42.5%, 10mg -51.7%를 기록했다. 위약 투여군은 -5.4%였다.10mg 투여군의 84.9%는 12주차에 30% 이상 지방간이 감소했다. 1mg 2.5mg 5mg 투여군에서 30% 이상 지방가 감소는 각각 59.2% 77.6% 66.7%였다. 위약 투여군에서는 13.6%에 그쳤다.
브라이언 리안 바이킹 대표는 “지금까지 보고된 경구용 제제의 NASH 임상 2상 결과 중 가장 큰 지방간 감소”라며 “이러한 결과는 조직학적 변화의 가능성을 시사한다”고 말했다.
VK2809 투여군은 심혈관계 위험성을 높이는 트리글리세리드, 저밀도지질단백질-콜레스테롤(LDL-C) 등의 수치도 위약군 대비 통계적으로 유의하게 감소했다. VK2809의 안전성과 내약성도 확인했다. 이상반응으로 인한 중단은 VK2809 투여군 및 위약군에서 유사하게 나타났다.
美마드리갈, 올 2분기 허가 신청 목표
NASH는 음주 외의 이유로 간에 지방이 쌓이고 염증이 진행되는 만성질환이다. 간경변이나 간암으로 악화될 수 있다. 지금까지 미국 식품의약국(FDA)으로부터 허가받은 NASH 치료제는 없다.VK2809는 간의 지방 대사에 관여하는 갑상선호르몬수용체베타(THRβ)를 활성화하는 기전이다. THRβ는 주로 간에 분포하는 수용체다. 활성화되면 지방간 축적을 줄이고 혈중 지질(콜레스테롤)을 감소시킨다.
미국 마드리갈파마수티컬스의 ‘레스메티롬’은 NASH 치료제 후보물질 중 개발 단계가 가장 앞서 있다. 레스메티롬도 THRβ를 활성화하는 기전이다. 마드리갈은 지난해 12월 레스메티롬의 임상 3상에 대한 주요(톱라인) 결과를 발표했다. 올해 2분기 FDA에 품목허가를 신청한다는 목표다. 한미약품은 글루카곤, GLP-1, GIP 수용체를 동시에 활성화하는 삼중작용제 ‘랩스트리플아고니스트’의 임상 2상을 진행 중이다. 최근 독립적데이터모니터링위원회(IDMC)로부터 임상 2상을 계속 진행하라는 권고를 받았다.
일동제약은 파네소이드X수용체(FXR)를 활성화하는 NASH 치료제를 개발 중이다. FXR이 활성화되면 간의 지질 및 당 대사, 담즙산 생성 및 배출, 염증 반응 등에 관여하는 것으로 알려졌다. 일동제약은 미국에서 건강한 성인을 대상으로 임상 1상을 진행하고 있다.
유한양행은 2019년 베링거인겔하임에 ‘YH25724’를 기술이전했다. YH25724는 GLP-1과 FGF21에 대한 이중작용제다. 베링거인겔하임은 YH25724의 1상을 유럽에서 진행 중이다. 박인혁 기자 hyuk@hankyung.com
**이 기사는 바이오·제약·헬스케어 전문 사이트 <한경 BIO Insight>에 2023년 5월 17일 9시 9분 게재됐습니다.